题目内容
8.下列有关物质性质、结构的表述均正确,且存在因果关系的是( )| 表述1 | 表述2 | |
| A | 在水中,NaCl的溶解度比I2的溶解度大 | NaCl晶体中Cl-与Na+间的作用力大于碘晶体中分子间的作用力 |
| B | 通常条件下,CH4分子比PbH4分子稳定性高 | Pb的原子半径比C的大,Pb与H之间的键能比C与H间的小 |
| C | 同一主族的元素在形成化合物时,化合价一定均相同 | 同一主族元素原子的最外层电子数相同 |
| D | P4O10、C6H12O6溶于水后均不导电 | P4O10、C6H12O6均属于共价化合物 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.溶解度与离子键、分子间作用力的强弱无关;
B.分子的键能越大,分子越稳定;
C.同一主族元素的最外层电子数相同,但化合价不一定相同;
D.有些共价化合物类型的电解质的水溶液能导电.
解答 解:A.溶解度与离子键、分子间作用力的强弱无关,碘为非极性分子,难以溶于极性溶剂,故A错误;
B.CH4分子比PbH4分子稳定性高的原因是C与H间的键能大于Pb与H之间的键能,故B正确;
C.同一主族元素的最外层电子数相同,但化合价不一定相同,如O无正价,但S的最高正价为+6价,故C错误;
D.氯化氢为共价化合物,水溶液能导电,P4O10、C6H12O6溶于水后均不导电,是因为二者为非电解质,故D错误;
故选B.
点评 本题考查原子的结构与元素的性质,题目难度中等,解答该题时注意找出反例,学习中注意把握元素周期律的递变规律.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
14.如果以乙烯为原料,经过两步反应制得乙二醇,则这两步反应的类型依次是( )
| A. | 加成反应、取代反应 | B. | 加成反应、消去反应 | ||
| C. | 取代反应、消去反应 | D. | 取代反应、加成反应 |
19.NA表示阿佛加德罗常数.下列说法中不正确的是( )
| A. | 常温常压下,4.5g${\;}_{7}^{15}$N${\;}_{3}^{+}$所含电子数为2NA个 | |
| B. | 1molFeCl3跟沸水完全反应转化为氢氧化铁胶体,其中胶体粒子的数目是NA | |
| C. | 4.5gSiO2晶体中含有的硅氧键数目为0.3NA | |
| D. | 氧气和臭氧的混合物1.6 g中含有0.1NA氧原子 |
16.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 0.1 mol苯中含有的碳碳双键数目为0.3 NA | |
| B. | 3.2g臭氧中含有的氧原子数为0.2NA | |
| C. | 1L0.1 mol•L-1 CH3COOH溶液中含有的氢原子数为0.4NA | |
| D. | 标准状况下,22.4 L盐酸中含有的HCl分子数为NA |
3.干冰所属晶体类型为( )
| A. | 原子晶体 | B. | 分子晶体 | C. | 金属晶体 | D. | 离子晶体 |
13.等温等压下,有质子数相等的CO、N2、C2H2三种气体.下列说法正确的是( )
| A. | 质量之比为1:1:1 | B. | 体积之比为4:14:13 | ||
| C. | 密度之比为13:13:14 | D. | 原子个数之比为1:1:2 |
20.Mn和Bi形成的晶体薄膜是一种金属间化合物(晶胞结构如图),有关说法正确的是( )

| A. | 锰价电子排布为3d74s0 | B. | Bi是d区金属 | ||
| C. | 该合金堆积方式是简单立方 | D. | 该晶体的化学式为MnBi |
15.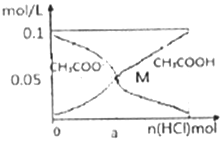 常温下向l0mL0.1mol•L-1CH3COONa溶液中,不断通入HCl气体后,CH3COO-与CH3COOH浓度的变化趋势如图所示(不考虑溶液休积变化),下列说法不正确的是( )
常温下向l0mL0.1mol•L-1CH3COONa溶液中,不断通入HCl气体后,CH3COO-与CH3COOH浓度的变化趋势如图所示(不考虑溶液休积变化),下列说法不正确的是( )
 常温下向l0mL0.1mol•L-1CH3COONa溶液中,不断通入HCl气体后,CH3COO-与CH3COOH浓度的变化趋势如图所示(不考虑溶液休积变化),下列说法不正确的是( )
常温下向l0mL0.1mol•L-1CH3COONa溶液中,不断通入HCl气体后,CH3COO-与CH3COOH浓度的变化趋势如图所示(不考虑溶液休积变化),下列说法不正确的是( )| A. | 当n(HCl)=1.0×10-3mol时,溶液中 c(Na+)=c(Cl-)>c(H+)>c(CH3COO-)>c(OH-) | |
| B. | M点溶液中水的电离程度比原溶液小 | |
| C. | 随着HCl的通入,c(OH-)/c(CH3COO-) 值不断减小 | |
| D. | 在M 点时,c(H+)-c(OH-)=(a-0.05)mol/L |

