题目内容
16.同分异构体现象在有机化学中是非常普遍的,下列有机物互为同分异构体的是( )①CH2=CHCH3
②

③CH3CH2CH3
④HC CCH3
⑤

⑥CH3CH=CHCH3.
| A. | ①和⑥ | B. | ①和③ | C. | ①和④ | D. | ⑤和⑥ |
分析 同分异构体是指分子式相同,但结构不同的有机化合物,据此分析.
解答 解:①和②的分子式为C3H6,且结构不相同,属于同分异构体;
③分子式为C3H8④分子式为C3H4 ⑤分子式为C4H8 ⑥分子式为C4H8,
⑤和⑥分子式相同、结构不同,属于同分异构体,
故选D.
点评 本题考查有机物的同分异构体的判断,难度不大,注意结构不同包含碳链异构、官能团位置异构、种类异构(官能团异构)等.

练习册系列答案
相关题目
8.下列有关物质性质、结构的表述均正确,且存在因果关系的是( )
| 表述1 | 表述2 | |
| A | 在水中,NaCl的溶解度比I2的溶解度大 | NaCl晶体中Cl-与Na+间的作用力大于碘晶体中分子间的作用力 |
| B | 通常条件下,CH4分子比PbH4分子稳定性高 | Pb的原子半径比C的大,Pb与H之间的键能比C与H间的小 |
| C | 同一主族的元素在形成化合物时,化合价一定均相同 | 同一主族元素原子的最外层电子数相同 |
| D | P4O10、C6H12O6溶于水后均不导电 | P4O10、C6H12O6均属于共价化合物 |
| A. | A | B. | B | C. | C | D. | D |
7.下列物质中,既含离子键又含有共价键的是( )
| A. | 铁 | B. | 氢氧化钠 | C. | 氯化钠 | D. | 水 |
4.下列说法或表示方法中正确的是( )
| A. | 对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同 | |
| B. | 等质量的硫蒸气和固态硫单质分别完全燃烧,后者放出的热量多 | |
| C. | 表示氢气燃烧热的△H为-285.8 kJ•mol-1,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 | |
| D. | 已知中和热△H为-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ |
1.下列离子方程式不正确的是( )
| A. | 铁与稀硫酸反应:Fe+2H+=Fe3++H2↑ | |
| B. | 铜跟硝酸银溶液反应:Cu+2Ag+=Cu2++2Ag | |
| C. | 氢氧化铝与足量盐酸反应:Al(OH)3+3H+=Al3++3H2O | |
| D. | 铜和三氯化铁溶液反应:Cu+Fe3+=Fe2++Cu2+ |
8.一些常见有机物的转化如图,下列说法正确的是( )


| A. | 上述有机物中只有C6H12O6属于糖类物质 | |
| B. | 物质A和B都属于电解质 | |
| C. | 物质C和油脂类物质互为同系物 | |
| D. | 转化1可在人体内完成,该催化剂属于蛋白质 |
5.下列反应中,生成物的总能量高于反应物的总能量的是( )
| A. | 煅烧石灰石 | B. | 锌与稀硫酸反应 | ||
| C. | NaOH溶液和稀盐酸反应 | D. | 铝热反应 |
15. 有X、Y、Z、W、A、B六种元素.其相关信息如下:
有X、Y、Z、W、A、B六种元素.其相关信息如下:
请回答下列有关问题:
(1)根据信息分析元素Y是F(填元素符号),A在元素周期表中的位置是第四周期VIII.
(2)BX3分子的中心原子采取的杂化类型是sp3.
(3)光谱证实单质 Z与强碱溶液反应生成[Z(OH)4]-,该原子的空间构型是正四面体型,[Z(OH)4]-离子中存在的化学键有ACD (填字母)
A.极性共价键 B.非极性共价键 C.配位键 D.σ键 E.π键
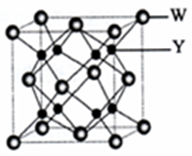
(4)Y与W可形成离子化合物,其晶胞结构如下图所示.W离子采取的堆枳方式是面心立方堆积,W离子的配位数为8,W离子的配位数为此空多余,Y离子占据空位四面体(填“四面体或八面体”).若该晶体的密度为dg•cm-3,则该晶胞中最近的Y离子与W离子间的距离是$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{78×4}{{N}_{A}×d}}$cm,(设NA为阿佛加德罗常数的值,只需列出计算表达式)
 有X、Y、Z、W、A、B六种元素.其相关信息如下:
有X、Y、Z、W、A、B六种元素.其相关信息如下:请回答下列有关问题:
| 元素 | 相关信息 | ||||||||||||||
| X | X原子的1s轨道上只有1个电子 | ||||||||||||||
| Y | Y是周期表中电负性最大的元素 | ||||||||||||||
| Z | Z是第三周期主族元素,其电离能l1~l7如下表所示(单位:KJ/mol)
| ||||||||||||||
| W | W是主族元素且与A同周期,其最外电子层上有两个运动状态不同的电子 | ||||||||||||||
| A | A是过渡元素,其基态原子的外围电子排布图为: | ||||||||||||||
| B | B元素基态原子的2p轨道中有三个未成对的电子 |
(2)BX3分子的中心原子采取的杂化类型是sp3.
(3)光谱证实单质 Z与强碱溶液反应生成[Z(OH)4]-,该原子的空间构型是正四面体型,[Z(OH)4]-离子中存在的化学键有ACD (填字母)
A.极性共价键 B.非极性共价键 C.配位键 D.σ键 E.π键
(4)Y与W可形成离子化合物,其晶胞结构如下图所示.W离子采取的堆枳方式是面心立方堆积,W离子的配位数为8,W离子的配位数为此空多余,Y离子占据空位四面体(填“四面体或八面体”).若该晶体的密度为dg•cm-3,则该晶胞中最近的Y离子与W离子间的距离是$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{78×4}{{N}_{A}×d}}$cm,(设NA为阿佛加德罗常数的值,只需列出计算表达式)