题目内容
19.在一定温度下,向一个容积可变的恒压容器中,通入3mol SO2和2mol O2及固体催化剂,使之反应:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1,平衡时容器内气体压强为起始时的90%.保持同一反应温度,在相同容器中,将起始物质的量改为4mol SO2、3mol O2、2mol SO3(g),下列说法正确的是( )
| A. | 第一次实验平衡时反应放出的热量为294.9kJ | |
| B. | 两次实验平衡时,SO2的转化率相等 | |
| C. | 第二次实验达平衡时SO3的体积分数大于$\frac{2}{9}$ | |
| D. | 达平衡时,O2表示的反应速率为0.25mol/(L•min) |
分析 A.平衡时容器内气体压强为起始时的90%,根据三段式可计算出第一次平衡时参加反应的二氧化硫为1mol,结合热化学方程式计算放出的热量;
B.第二次等效为开始加入6mol SO2、4mol O2,为进一步等效在原平衡的基础上增大压强,平衡正向移动;
C.等效为开始加入6mol SO2、4mol O2,进一步等效在原平衡的基础上增大压强,平衡正向移动,新平衡时SO3的体积分数大于第一次平衡;
D.根据v=$\frac{△c}{△t}$计算v(O2),容积可变的恒压容器中无法计算.
解答 解:A.恒温恒容下,压强之比等于物质的量之比,则平衡时混合气体总物质的量为(3mol+2mol)×90%=4.5mol,则:
2SO2(g)+O2(g)?2SO3(g)△n=1
起始量(mol):3 2 0
变化量(mol):1 0.5 1 5-4.5=0.5
平衡量(mol):2 1.5 1
第一次平衡时参加反应的二氧化硫为1mol,则第一次平衡时反应放出的热量为196.6kJ×$\frac{1mol}{2mol}$=98.3 kJ,故A错误;
B.保持同一反应温度,在相同容器中,将起始物质的量改为4mol SO2、3mol O2、2mol SO3(g),等效为开始加入6mol SO2、4mol O2,相对于第一次在一定温度下,向一个容积可变的恒压容器中,通入3mol SO2和2mol O2及固体催化剂,为进一步等效在原平衡的基础上增大压强,平衡正向移动,第二次平衡时SO2的转化率大于第一次,故B错误;
C.第一次平衡时SO3的体积分数=$\frac{1mol}{4.5mol}$=$\frac{2}{9}$,将起始物质的量改为4mol SO2、3mol O2、2mol SO3(g),等效为开始加入6mol SO2、4mol O2,进一步等效在原平衡的基础上增大压强,平衡正向移动,新平衡时SO3的体积分数大于第一次平衡,即第二次达平衡时SO3的体积分数大于$\frac{2}{9}$,故C正确;
D.容器容积未知、到达平衡时间未知,不能计算反应速率,故D错误;
故选C.
点评 本题考查化学平衡计算,B选项注意利用等效思想解答,关键是构建平衡建立的途径,题目难度中等.

| A. | 达到化学平衡时,将完全转化为NH3 | |
| B. | 达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 | |
| C. | 达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 | |
| D. | 达到化学平衡时,正反应速率和逆反应速率都为零 |
| A. | HCI+NaOH═NaCl+H2O | |
| B. | Zn+2HCl═ZnCl2+H2↑ | |
| C. | HCl+AgNO3═AgCl↓+HNO3 | |
| D. | MnO2+4HCI (浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+C12↑+2H2O |
| A. | 气体分子的直径 | B. | 气体分子间的平均距离 | ||
| C. | 气体的分子数目 | D. | 气体分子的摩尔质量 |
| A. | Fe2(SO4)3和 Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| B. | 碳酸钡加入稀硫酸:BaCO3+2H+═Ba2++H2O+CO2↑ | |
| C. | 向碳酸氢钙溶液中加入过量氢氧化钠:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| D. | 等物质的量的MgCl2、Ba(OH)2和 HC1溶液混合:Mg2++2OH-═Mg(OH)2↓ |
(1)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2发生反应,则下列说法正确的是DE
A.若反应速率v(SO2)﹦v(SO3),则可以说明该可逆反应已达到平衡状态
B.保持温度和容器体积不变,充入2mol N2,化学反应速率加快
C.平衡后仅增大反应物浓度,则平衡一定右移,各反应物的转化率一定都增大
D.平衡后移动活塞压缩气体,平衡时SO2、O2的百分含量减小,SO3的百分含量增大
E.保持温度和容器体积不变,平衡后再充入2mol SO3,再次平衡时SO2的百分含量比原平衡时SO2的百分含量小
F.平衡后升高温度,平衡常数K增大
(2)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如表中的两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | y | 9 |
②T1>T2,(选填“>”、“<”或“=”),实验2中达平衡时 O2的转化率为90%;
(3)尾气SO2用NaOH溶液吸收后会生成Na2SO3.现有常温下0.1mol/L Na2SO3溶液,实验测定其pH约为8,完成下列问题:
①用离子方程式表示该溶液呈碱性的原因:SO32-+H2O?HSO3-+OH-;
②该溶液中c(OH-)=c(H+)+c(HSO3-)+2c(H2SO3)(用溶液中所含微粒的浓度表示).
(4)如果用含等物质的量溶质的下列各溶液分别来吸收SO2,则理论吸收量由多到少的顺序是B>C=D>A
A.Na2CO3 B.Ba(NO3)2 C.Na2S D.酸性KMnO4.
| A. | 2-甲基丙烷 | B. | 三硝基甲苯 | C. | 乙酸甲酯 | D. | 乙二酸 |
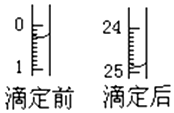 某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定法测定其浓度.
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定法测定其浓度.