题目内容
14. 某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定法测定其浓度.
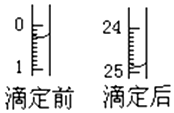
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定法测定其浓度.(1)滴定:根据如图表示某次滴定时50mL滴定管中前后液面的位罝计算用去的标准盐酸的体枳为24.60.
(2)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
a.若滴定前用待测液润洗锥形瓶随,则会使测定结果无影响;
b.读数时,若滴定前仰视,滴定后俯视.则会使测定结果偏低.
分析 (1)根据滴定管的结构以及测量体积的原理可知消耗标准液的体积等于滴后体积减去滴前体积;
(2)根据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$,分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:(1)滴定前读数为:0.30mL,滴定后读数为:24.90mL,消耗溶液的体积为24.60mL,
故答案为:24.60;
(2)根据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$,分析不当操作对V(标准)的影响,以此判断浓度的误差:
a.若滴定前用蒸馏水冲洗锥形瓶,待测液的物质的量不变,对V(标准)无影响,可知c(待测)无影响,故答案为:无影响;
b.读数时,若滴定前仰视,滴定后俯视,造成V(标准)偏小,可知c(待测)偏低,故答案为:偏低.
点评 本题考查了中和滴定时的读数及误差分析,要求掌握滴定管的结构和中和滴定的实验原理,试题难易适中,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力.

练习册系列答案
相关题目
4. (1)实验室配制1000mL0.50mol•L-1的Na2CO3溶液,在常用仪器中应选用1000mL的容量瓶,称量时若将法码放在左盘(1g以下用游码),则配制的溶液的物质的量浓度等于0.50mol•L-1(填“大于”、“小于”或“等于”).
(1)实验室配制1000mL0.50mol•L-1的Na2CO3溶液,在常用仪器中应选用1000mL的容量瓶,称量时若将法码放在左盘(1g以下用游码),则配制的溶液的物质的量浓度等于0.50mol•L-1(填“大于”、“小于”或“等于”).
(2)配制完毕后,用标准Na2CO3溶液滴定未知浓度的盐酸时,Na2CO3溶液应装在碱式滴定管中.若采用上述标准Na2CO3溶液滴定,滴定时实验数据列表如下:
则c(HCl)=0.85mol•L-1.
(3)若盛装Na2CO3溶液的滴定管在滴定前未用标准液润洗,则最后所测盐酸浓度偏高,若原来配制所称取的Na2CO3固体中混有Na2CO3•10H2O,则实验误差为偏高(以上两空填“偏高”、“偏低”或“无影响”)
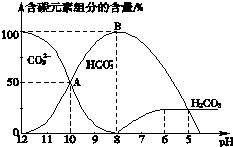
(4)常温下向20mL 0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液40mL,溶液pH逐渐降低,此时溶液中含碳元素的微粒的物质的量浓度的百分含量(纵轴)发生的变化(CO2因逸出未画出)如图所示,根据图示回答下列问题:
①请写出AB段反应的离子方程式CO32-+H+=HCO3-
②当反应到A点时,溶液中所有阳离子和阴离子的浓度大小关系为(氯离子浓度除外)c(Na+)+c(H+)>2c(CO32-)+c(HCO3-)+c(OH-).
 (1)实验室配制1000mL0.50mol•L-1的Na2CO3溶液,在常用仪器中应选用1000mL的容量瓶,称量时若将法码放在左盘(1g以下用游码),则配制的溶液的物质的量浓度等于0.50mol•L-1(填“大于”、“小于”或“等于”).
(1)实验室配制1000mL0.50mol•L-1的Na2CO3溶液,在常用仪器中应选用1000mL的容量瓶,称量时若将法码放在左盘(1g以下用游码),则配制的溶液的物质的量浓度等于0.50mol•L-1(填“大于”、“小于”或“等于”).(2)配制完毕后,用标准Na2CO3溶液滴定未知浓度的盐酸时,Na2CO3溶液应装在碱式滴定管中.若采用上述标准Na2CO3溶液滴定,滴定时实验数据列表如下:
| 次数编号 | 待测盐酸体积(mL) | 滴入Na2CO3溶液体积(mL) |
| 1 | 20.00 | 18.80 |
| 2 | 20.00 | 16.95 |
| 3 | 20.00 | 17.05 |
(3)若盛装Na2CO3溶液的滴定管在滴定前未用标准液润洗,则最后所测盐酸浓度偏高,若原来配制所称取的Na2CO3固体中混有Na2CO3•10H2O,则实验误差为偏高(以上两空填“偏高”、“偏低”或“无影响”)
(4)常温下向20mL 0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液40mL,溶液pH逐渐降低,此时溶液中含碳元素的微粒的物质的量浓度的百分含量(纵轴)发生的变化(CO2因逸出未画出)如图所示,根据图示回答下列问题:
①请写出AB段反应的离子方程式CO32-+H+=HCO3-
②当反应到A点时,溶液中所有阳离子和阴离子的浓度大小关系为(氯离子浓度除外)c(Na+)+c(H+)>2c(CO32-)+c(HCO3-)+c(OH-).
5.某元素的M层有4个P电子,下列叙述错误的是( )
| A. | N层不含电子 | B. | 该元素是硫元素 | ||
| C. | L层一定有8个电子 | D. | 原子最外层电子数为4 |
2.下列分子均属于极性分子且中心原子均为sp3杂化的是( )
| A. | CH4、P4 | B. | SO2、CHCl3 | C. | PCl3、SO3 | D. | NH3、H2O |
9.在澄清透明溶液中,下列各组离子能大量共存的是( )
| A. | HCO3-、ClO-、Na+、H+ | B. | Cl-、NH4+、NO3-、H+ | ||
| C. | K+、Cu2+、Cl-、SO42- | D. | OH-、Mg2+、Na+、CO32- |
19.在一定温度下,向一个容积可变的恒压容器中,通入3mol SO2和2mol O2及固体催化剂,使之反应:
2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1,平衡时容器内气体压强为起始时的90%.保持同一反应温度,在相同容器中,将起始物质的量改为4mol SO2、3mol O2、2mol SO3(g),下列说法正确的是( )
2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1,平衡时容器内气体压强为起始时的90%.保持同一反应温度,在相同容器中,将起始物质的量改为4mol SO2、3mol O2、2mol SO3(g),下列说法正确的是( )
| A. | 第一次实验平衡时反应放出的热量为294.9kJ | |
| B. | 两次实验平衡时,SO2的转化率相等 | |
| C. | 第二次实验达平衡时SO3的体积分数大于$\frac{2}{9}$ | |
| D. | 达平衡时,O2表示的反应速率为0.25mol/(L•min) |
9.氨基甲酸铵(NH2COONH4)是一种用途广泛的化工原料,其制备原理为:2NH3(g)+C02(g)?NH2C00NH4(s).实验室可用如图1所示装置制备: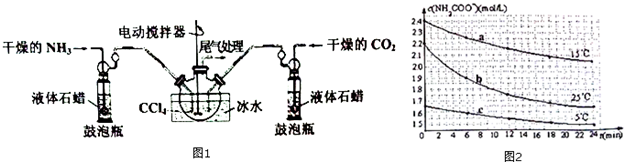
请回答下列问题:
(1)制备NH2COONH4的反应在一定条件下能自发进行,该反应的△H<0(填“>”“=”或“<”);要提高NH2COONH4的产率可采取的措施为增大压强、适当降低温度.
(2)装置中盛液体石蜡的鼓泡瓶作用是通过观察气泡,使气体流速均匀,调节NH3与CO2通入比例.
(3)一定条件下,在恒容密闭容器中通入体积比为2:1的NH3和CO2制备NH2COONH4固体.
①下列能说明反应达到平衡状态的是bd.
a、NH3和CO2物质的量之比为2:1
b.密闭容器中混合气体的密度不变
c、反应的焓变不变
d.固体的质量不在发生变化
②实验测得不同温度下达到平衡时气体的总浓度如表
30.0℃时该反应平衡常数K的计算式为$\frac{1}{(\frac{2}{3}×4.8×1{0}^{-3})^{2}×(\frac{1}{3}×4.8×1{0}^{-3})}$(不必计算结果)
(4)己知:NH2C00NH4+2H20?NH4HCO3+NH3•H2O.分别用三份不份不同初始浓度的NH2COONH4溶液测定不同温度下的水解反应速率,得到c(NH2COO-)随时间变化趋势如图2所示.
①15℃时,0~6min内NH2COONH4水解反应的平均速率为0.05mol/(L•min).
②对比图中曲线a、b、c可知,水解反应速率最大的是b.

请回答下列问题:
(1)制备NH2COONH4的反应在一定条件下能自发进行,该反应的△H<0(填“>”“=”或“<”);要提高NH2COONH4的产率可采取的措施为增大压强、适当降低温度.
(2)装置中盛液体石蜡的鼓泡瓶作用是通过观察气泡,使气体流速均匀,调节NH3与CO2通入比例.
(3)一定条件下,在恒容密闭容器中通入体积比为2:1的NH3和CO2制备NH2COONH4固体.
①下列能说明反应达到平衡状态的是bd.
a、NH3和CO2物质的量之比为2:1
b.密闭容器中混合气体的密度不变
c、反应的焓变不变
d.固体的质量不在发生变化
②实验测得不同温度下达到平衡时气体的总浓度如表
| 温度(℃) | 20.0 | 30.0 | 40.0 |
| 平衡时气体总浓度 (×10-3mol•L-1) | 3.4 | 4.8 | 6.8 |
(4)己知:NH2C00NH4+2H20?NH4HCO3+NH3•H2O.分别用三份不份不同初始浓度的NH2COONH4溶液测定不同温度下的水解反应速率,得到c(NH2COO-)随时间变化趋势如图2所示.
①15℃时,0~6min内NH2COONH4水解反应的平均速率为0.05mol/(L•min).
②对比图中曲线a、b、c可知,水解反应速率最大的是b.
10.下列分离提纯所选用的试剂正确的是( )
| A. | 除去O2中混有的N2:选用灼热的铜网 | |
| B. | 提取碘水中的碘单质:选用有机试剂苯 | |
| C. | 除去CO2中混有的CO:选用适量澄清石灰水 | |
| D. | 除去Mg粉中混有的MgO:选用过量稀盐酸 |
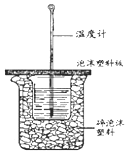 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题: