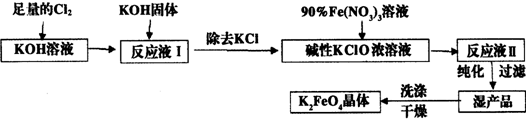
题目内容
5.下列有关FeCl3溶液的叙述正确的是( )| A. | 该溶液中,K+、Fe2+、SCN-、Br-可以大量共存 | |
| B. | 与KI溶液反应的离子方程式为Fe3++2I-═Fe2++I2 | |
| C. | 与Na2CO3溶液反应的离子方程式为2Fe3++3CO32-+3H2O═2Fe(OH)3↓+3CO2↑ | |
| D. | 与Mg(OH)2悬浊液反应的离子方程式为3OH-+Fe3+═Fe(OH)3↓ |
分析 A.铁离子与硫氰根离子反应生成硫氰化铁;
B.离子方程式两边总电荷不相等,违反了电荷守恒;
C.铁离子与碳酸根离子发生双水解反应生成氢氧化铁沉淀和二氧化碳气体;
D.氢氧化铁更难溶,氢氧化镁沉淀转化成氢氧化铁沉淀,氢氧化镁不能拆开.
解答 解:A.氯化铁溶液中含有铁离子,SCN-与Fe3+发生反应生成络合物硫氰化铁,在溶液中不能大量共存,故A错误;
B.氯化铁KI溶液发生氧化还原反应,反应的离子方程式为:2Fe3++2I-═2Fe2++I2,故B错误;
C.氯化铁与Na2CO3溶液发生双水解反应,反应的离子方程式为:2Fe3++3CO32-+3H2O═2Fe(OH)3↓+3CO2↑,故C正确;
D.氯化铁与Mg(OH)2悬浊液反应生成氢氧化铁沉淀,正确的离子方程式为:3Mg(OH)2+2Fe3+═2Fe(OH)3+Mg2+,故D错误;
故选C.
点评 本题考查离子共存、离子方程式书写判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,熟练掌握离子方程式的书写原则,试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
14.具有显著抗癌活性的10-羟基喜树碱的结构如图所示.下列关于10-羟基喜树碱的说法正确的是( )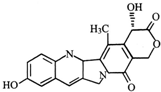

| A. | 该物质属于芳香烃 | |
| B. | 该物质能与NaHCO3反应 | |
| C. | 该物质中存在三个苯环 | |
| D. | 一定条件下,1mol该物质最多可与2mol NaOH发生反应 |
20.化学与社会、生产、生活密切相关.下列说法正确的是( )
| A. | 聚氯乙烯可用作制食品包装袋的原料 | |
| B. | 从海水中提取物质都必须通过化学反应才能实现 | |
| C. | 晶体硅可用作制造太阳能电池和光导纤维 | |
| D. | 含硫燃料燃烧产生的二氧化硫是形成酸雨的罪魁祸首 |
15.下列说法正确的是( )
| A. | 常温下,C(s)+H2O(g)?CO(g)+H2(g) 不能自发进行,则该反应的△H>0 | |
| B. | 25℃时,向0.1 mol•L-1CH3COOH溶液中加水稀释,$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$逐渐增大 | |
| C. | Ba的金属活动性强于Mg,可以通过电解BaCl2溶液的方法获得金属钡 | |
| D. | 对硫酸工业中的反应:2SO2(g)+O2(g)?2SO3(g)△H<0,采用500℃左右的高温主要是为了加快反应速率 |
12.下列离子方程式书写正确的是( )
| A. | 向饱和CaCl2溶液中通入少量的CO2:Ca2++CO2+H2O═CaCO3↓+2H+ | |
| B. | 向碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-═CO32-+H2O | |
| C. | 向Cu粉中加入过量的浓HNO3:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| D. | 氯化铵溶液显酸性的原因:NH4++OH-=NH3•H2O+H+ |

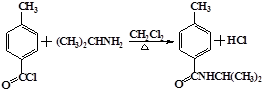 .
. .
.