题目内容
标准状况下,aL气体X2和bL气体Y2恰好完全反应生成cL气体Z,若2a=6b=3c,则Z的化学式为
A.X3Y B.XY3 C.XY2 D.X2Y
练习册系列答案
相关题目
2.下列有关物质用途的说法中,不正确的是( )
| A. | 明矾可作净水剂 | |
| B. | 硅可制作半导体材料 | |
| C. | 氢氧化钠常用于中和胃酸 | |
| D. | 常温下,铁制容器可用于盛装浓硫酸 |
5.下列有关FeCl3溶液的叙述正确的是( )
| A. | 该溶液中,K+、Fe2+、SCN-、Br-可以大量共存 | |
| B. | 与KI溶液反应的离子方程式为Fe3++2I-═Fe2++I2 | |
| C. | 与Na2CO3溶液反应的离子方程式为2Fe3++3CO32-+3H2O═2Fe(OH)3↓+3CO2↑ | |
| D. | 与Mg(OH)2悬浊液反应的离子方程式为3OH-+Fe3+═Fe(OH)3↓ |
13. 甲、乙、丙、丁、戊五种物质中,甲、乙、丙均含有相同的某种元素,丁是一种常见气体单质,它们之间具有如图所示转化关系.下列有关物质的推断不正确的是( )
甲、乙、丙、丁、戊五种物质中,甲、乙、丙均含有相同的某种元素,丁是一种常见气体单质,它们之间具有如图所示转化关系.下列有关物质的推断不正确的是( )
 甲、乙、丙、丁、戊五种物质中,甲、乙、丙均含有相同的某种元素,丁是一种常见气体单质,它们之间具有如图所示转化关系.下列有关物质的推断不正确的是( )
甲、乙、丙、丁、戊五种物质中,甲、乙、丙均含有相同的某种元素,丁是一种常见气体单质,它们之间具有如图所示转化关系.下列有关物质的推断不正确的是( )| A. | 若甲为Na,则戊可能是H2O | B. | 若甲为C2H4,则戊可能是O2 | ||
| C. | 若甲为NO,则戊可能是H2O | D. | 若甲为Cl2,则戊可能是NaOH溶液 |
17.含重铬酸钾(K2Cr2O7)废水普遍存在于制明矾、火柴的工厂,由于K2Cr2O7直接排放会污染环境,因此需要进行处理.某研究小组查阅资料发现:
①
②生成氢氧化物沉淀的pH
③药剂还原沉淀法是目前应用较为广泛的含铬废水处理方法,其基本原理是在酸性条件下向废水中加入还原剂将Cr2O72-还原成Cr3+,然后再加入石灰或氢氧化钠,使其转化成Cr(OH)3沉淀,从而除去Cr2O72-.
(1)配平方程式:1Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O
(2)写出在含Cr3+溶液中加入NaOH反应的离子方程式:Cr3++3OH-=Cr(OH)3↓.
该研究小组设计方案进行实验室模拟,想利用电解法产生Fe2+,进而处理含K2Cr2O7的废水,实验如下:
(3)a 极的电极材料是Fe.该小组通过实验证明了a极区产生了Fe2+,请描述他们的实验操作取a 极区少量溶液于试管中,向其中滴加铁氰化钾溶液,有蓝色沉淀产生.
该小组同学再次查阅资料,将上述实验方案进一步优化,进行了实验Ⅱ:
(4)请将实验现象补充完整;解释b极区产生红褐色沉淀的原因b极H+放电,溶液pH升高,a 极产生的Fe2+被Cr2O72-氧化成Fe3+,Fe3+迁移到b极区,与OH-结合生成Fe(OH)3.
(5)实验Ⅰ→实验Ⅱ进行了优化,对比实验Ⅰ、Ⅱ,说明优化的依据是调节溶液pH为酸性,保证Cr2O72-的氧化性.
(6)该小组同学想在电解过程中将Cr2O72-转化为Cr(OH)3沉淀除去,请提出措施并说明理由增大溶液pH到合理范围 使Cr2O72-与Fe2+发生反应且Cr(OH)3能沉淀.
①
| 物质 | K2Cr2O7溶液 | Cr(OH)3 | Cr3+溶液 |
| 颜色 | 橙黄色 | 灰绿色沉淀 | 灰绿色 |
| Fe(OH)3 | Cr(OH)3 | |
| 开始沉淀时 | 1.5 | 6.0 |
| 沉淀完全时 | 2.8 | 8.0 |
(1)配平方程式:1Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O
(2)写出在含Cr3+溶液中加入NaOH反应的离子方程式:Cr3++3OH-=Cr(OH)3↓.
该研究小组设计方案进行实验室模拟,想利用电解法产生Fe2+,进而处理含K2Cr2O7的废水,实验如下:
| 实验 序号 | 实验装置 | 实验电压 | 溶液 | 时间 | 现象 |
| Ⅰ |  | 22V | 0.01mol/L K2Cr2O7溶液 | 20 分钟 | a 极区无明显现象; b 极区有无色气泡. |
该小组同学再次查阅资料,将上述实验方案进一步优化,进行了实验Ⅱ:
| 实验 序号 | 实验装置 | 实验电压 | 溶液 | 时间 | 现象 |
| Ⅱ |  | 22V | 0.01mol/LK2Cr2O7溶液中加入少量H2SO4酸 化,使pH≈1 | 20 分钟 | a 极区溶液变浅绿色; b极区有无色气泡产生,产生红褐色沉淀. |
(5)实验Ⅰ→实验Ⅱ进行了优化,对比实验Ⅰ、Ⅱ,说明优化的依据是调节溶液pH为酸性,保证Cr2O72-的氧化性.
(6)该小组同学想在电解过程中将Cr2O72-转化为Cr(OH)3沉淀除去,请提出措施并说明理由增大溶液pH到合理范围 使Cr2O72-与Fe2+发生反应且Cr(OH)3能沉淀.



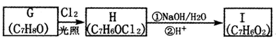
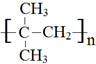 .
.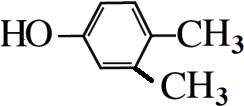 .
.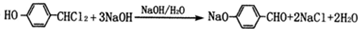 .
. .
.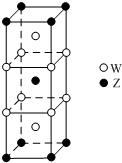 短周期元素T、X、Y、Z的原子序数依次增大,其中元素T、X基态原子均有2个未成对电子,元素Y基态原子s能级的电子总数与p能级的电子总数相等,元素Z的价电子数等于能层数.元素W位于第四周期,其基态原子所含未成对电子数在该周期中最多.
短周期元素T、X、Y、Z的原子序数依次增大,其中元素T、X基态原子均有2个未成对电子,元素Y基态原子s能级的电子总数与p能级的电子总数相等,元素Z的价电子数等于能层数.元素W位于第四周期,其基态原子所含未成对电子数在该周期中最多.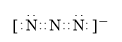 .
.