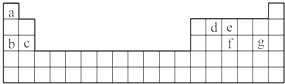
题目内容
16.某河道两旁有甲乙两厂.它们排放的工业废水中,共含K+、Ag+、Fe3+、Cl-、OH-、NO3-六种离子.(1)甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子OH-、Cl-、K+.乙厂的废水中含有另外三种离子.对于该两厂的废水,可采取下列两种方法来处理.如果在废水中加一定量铁粉,所发生的反应的离子方程式是Fe+2Ag+=Fe2++2Ag、Fe+2Fe3+=3Fe2+
(2)将甲厂和乙厂的废水按适当的比例混合,可以使废水中的某些离子转化为沉淀,写出两个离子方程式:
Fe3++3OH-=Fe(OH)3↓、Ag++Cl-=AgCl↓,经过滤后的废水主要含KNO3(或K+、NO3-),可用来浇灌农田.检验废水中含有的金属阳离子的方法是焰色反应,现象:透过蓝色钴玻璃可看到紫色火焰.
分析 (1)由“甲厂的废水明显呈碱性”,则甲中一定含OH-,不会含有与OH-反应生成沉淀的离子Ag+、Fe3+,故Ag+、Fe3+只能在乙车间的废水中;
乙厂的废水中存在Ag+,故Cl-就在甲厂的废水中;乙共含三种离子,已知两种阳离子Ag+、Fe3+,必须有一种阴离子,所以阴离子是NO3-;而甲中含有两种阴离子OH-和Cl-,故阳离子是K+;
乙厂废水中含Ag+、Fe3+、NO3-,由于铁比Ag活泼,所以可置换出金属Ag;
(2)两厂的废水按适当的比例混合时Ag+与Cl-结合,Fe3+与OH-结合,分别生成AgCl和Fe(OH)3两种沉淀而除掉,所以溶液中剩余K+和NO3-,构成KNO3.,检验钾离子利用焰色反应.
解答 解:(1)由“甲厂的废水明显呈碱性”,则甲中一定含OH-,不会含有与OH-反应生成沉淀的离子Ag+、Fe3+,故Ag+、Fe3+只能在乙车间的废水中;乙厂的废水中存在Ag+,故Cl-就在甲厂的废水中;乙共含三种离子,已知两种阳离子Ag+、Fe3+,必须有一种阴离子,所以阴离子是NO3-;而甲中含有两种阴离子OH-和Cl-,故阳离子是K+;综上所述,甲中含 OH-、Cl-、K+,乙厂废水中含Ag+、Fe3+、NO3-,加Fe发生的离子反应为Fe+2Ag+=Fe2++2Ag、Fe+2Fe3+=3Fe2+,
故答案为:OH-;Cl-;K+;Fe+2Ag+=Fe2++2Ag、Fe+2Fe3+=3Fe2+;
(2)将甲厂和乙厂的废水按适当的比例混合,发生Fe3++3OH-=Fe(OH)3↓、Ag++Cl-=AgCl↓,则经过滤后的废水主要含 KNO3(或K+、NO3-),可用来浇灌农田.检验废水中含有的金属阳离子的方法是焰色反应,现象为透过蓝色钴玻璃可看到紫色火焰,
故答案为:Fe3++3OH-=Fe(OH)3↓、Ag++Cl-=AgCl↓;KNO3(或K+、NO3-);焰色反应;透过蓝色钴玻璃可看到紫色火焰.
点评 本题考查无机物的推断,为高频考点,把握离子之间反应、离子共存、离子检验等知识等为解答的关键,侧重分析与推断能力的考查,注意甲为碱性为推断的突破口,题目难度不大.

 瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪能够在煤矿巷道中的甲烷浓度达到一定浓度时,可以通过传感器显示.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如下图所示,其中的固体电解质是 Y2O3-Na2O,O2-可以在其中自由移动.下列有关叙述正确的是( )
瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪能够在煤矿巷道中的甲烷浓度达到一定浓度时,可以通过传感器显示.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如下图所示,其中的固体电解质是 Y2O3-Na2O,O2-可以在其中自由移动.下列有关叙述正确的是( )| A. | 瓦斯分析仪工作时,电池内电路中电子由电极b 流向电极a | |
| B. | 电极b 是正极,O2-由电极 a流向电极b | |
| C. | 电极a的反应式为:CH4+4O2--8e-=CO2+2H2O | |
| D. | 当固体电解质中有1 mol O2- 通过时,电子转移 4 mol |
| 实验操作 | 实验现象 | 实验结论 | |
| A | SO2通入Ba(NO3)2溶液中 | 不产生沉淀 | 亚硫酸的酸性比硝酸弱 |
| B | 气体X通入酸性KMnO4中 | 溶液褪色 | 气体X有漂白性 |
| C | 取少量某无色溶液,先滴加氯水,再加入少量苯,振荡、静置 | 溶液分层,下层呈紫红色 | 原无色溶液中一定有I- |
| D | 将铜片放入稀硝酸中,加热 | 产生大量气体溶液变为蓝色 | 稀硝酸具有强氧化性和酸性 |
| A. | A | B. | B | C. | C | D. | D |
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、Cl-、OH-、SO42- |
①A、C溶液显碱性,A、B的溶液中水的电离程度相同;
②C和D的溶液混合反应的现象只是有白色沉淀生成,B和C的溶液混合反应的现象只是有刺激性气味的气体生成,A和D的溶液混合无明显现象.
(1)A是CH3COONa,B是NH4Cl.
(2)写出C与D的溶液反应的离子方程式Ba2++SO42-=BaSO4↓.
| A. | 由于分子中氢原子数:H2SO4>HClO4,故酸性:H2SO4>HClO4 | |
| B. | 硅处于金属与非金属的过渡位置,硅可用作半导体材料 | |
| C. | 由于氮元素的最低化合价只有-3价,故NH5这种物质不可能存在 | |
| D. | Cl-、S2-、Ca2+、K+半径逐渐减小 |
| 选项 | 实验事实 | 理论解释 |
| A | 氧化性:HClO>HClO4 | HClO4分子中非羟基氧原子数目较多 |
| B | 沸点:SiO2>CO2 | 相对分子质量越大沸点越高 |
| C | 密度:干冰>冰 | 干冰晶体属于分子密堆积 |
| D | 分解温度:MgO>NaCl | MgO晶格能大于NaCl |
| A. | A | B. | B | C. | C | D. | D |
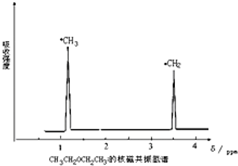 利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.在有机物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目.例如二乙醚的结构简式为:CH3-CH2-O-CH2-CH3,其核磁共振谱中给出的峰值(信号)有两个,如图所示:
利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.在有机物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目.例如二乙醚的结构简式为:CH3-CH2-O-CH2-CH3,其核磁共振谱中给出的峰值(信号)有两个,如图所示: