题目内容
写出下列物质在水溶液中的电离方程式
H2SO4: ;
Ca(OH)2: ;
Na2CO3: .
H2SO4:
Ca(OH)2:
Na2CO3:
考点:电离方程式的书写
专题:电离平衡与溶液的pH专题
分析:电离方程式是用化学式和离子符号表示电离过程的式子.注意:强电解质在溶液中能完全电离用“=”,弱电解质部分电离用“?”,多元弱酸,应分步电离,多元弱酸的酸式根离子在电离方程式中不能拆开,电离方程式遵循电荷守恒和原子个数守恒,据此进行分析解答.
解答:
解:硫酸是强电解质在水中完全电离,电离方程式为:H2SO4═2H++SO42-;
Ca(OH)2是强电解质在水中完全电离,电离方程式:Ca(OH)2=Ca2++2OH-;
Na2CO3是强电解质在水中完全电离,电离方程式为:Na2CO3=2Na++CO32-;
故答案为:H2SO4═2H++SO42-;Ca(OH)2=Ca2++2OH-;Na2CO3=2Na++CO32-.
Ca(OH)2是强电解质在水中完全电离,电离方程式:Ca(OH)2=Ca2++2OH-;
Na2CO3是强电解质在水中完全电离,电离方程式为:Na2CO3=2Na++CO32-;
故答案为:H2SO4═2H++SO42-;Ca(OH)2=Ca2++2OH-;Na2CO3=2Na++CO32-.
点评:本题考查了电解质电离方程式的书写,注意强电解质在溶液中能完全电离,弱电解质部分电离,强酸的酸式根离子要拆开,弱酸的酸式根离子不能拆开,题目难度不大.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
 如图所示为鲁科版化学教科书(我们正在使用的教科书)必修1中“迁移应用”栏目的一个学习活动.下列关于a、b、c、d处所填内容及这幅图含义的描述中,不正确的是( )
如图所示为鲁科版化学教科书(我们正在使用的教科书)必修1中“迁移应用”栏目的一个学习活动.下列关于a、b、c、d处所填内容及这幅图含义的描述中,不正确的是( )| A、a=1.204×1024、b=6.02×1023、c=2、d=1 |
| B、6.02×1023个H2O水分子中含有1.204×1024个氢原子和6.02×1023个氧原子 |
| C、1mol H2O中含有2mol H和1mol O |
| D、对于同一微粒,其物质的量与微粒数间可通过阿伏加德罗常数实现相互换算 |
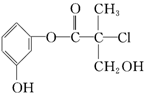 某有机物是药物生产的中间体,其结构简式如图.下列有关叙述正确的是( )
某有机物是药物生产的中间体,其结构简式如图.下列有关叙述正确的是( )| A、该有机物能与溴水发生加成反应 |
| B、该有机物与浓硫酸混合加热可发生消去反应 |
| C、1mol该有机物与足量NaOH溶液反应最多消耗3mol NaOH |
| D、该有机物经催化氧化后能发生银镜反应 |
用坩埚钳夹住一小块刚用酸充分处理过的铝箔,在酒精灯上加热至熔化,发现熔化的铝并不滴落.下列关于上述实验现象的解释正确的是( )
| A、火焰温度太低不能使铝燃烧 |
| B、铝在空气中能很快形成氧化膜 |
| C、氧化铝的熔点比铝的熔点低 |
| D、用酸处理时未能将氧化铝溶解 |
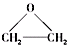 ),该反应的原子利用率为100%,反应的化学方程式为
),该反应的原子利用率为100%,反应的化学方程式为