题目内容
19.pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol•L-1,则该溶液中溶质的pC=3.下列说法正确的是( )| A. | 某温度下,任何电解质的水溶液中:pC(H+)+pC(OH-)=14 | |
| B. | 某温度下,AB难溶性离子化合物的Ksp=1.0×10-10,其饱和溶液中:pC(A+)+pC(B-)=10 | |
| C. | 0.01mol/L的盐酸滴定某浓度的氨水溶液,滴定终时:pC(Cl-)>pC(NH4+)>pC(H+)>pC(OH-) | |
| D. | 0.01mol/L的醋酸钠溶液中:pC(Na+)+pC(H+)=pC(OH)-+pC(CH3COO-) |
分析 A.Kw的大小受到温度的影响,pC(H+)+pC(OH-)=-lgKw;
B.由Ksp表达式和pC定义即可计算出pC(A+)+pC(B-)的大小;
C.离子浓度与pC成反比,离子浓度越大,pC只越小;
D.醋酸钠溶液中满足电荷守恒:c(Na+)+c(H+)=c(OH)-+c(CH3COO-),但是不一定满足pC(Na+)+pC(H+)=pC(OH)-+pC(CH3COO-).
解答 解:A.Kw的大小受到温度的影响,温度越高Kw越大,Kw=C(H+)•C(OH-),pC(H+)+pC(OH-)=-lgC(H+)•C(OH-)=-lgKw,只有在常温下kw=10-14,pC(H+)+pC(OH-)=14,故A错误;
B.因为Ksp=C(A+)•C(B-)=1.0×10-10,所以pC(A+)+pC(B-)=-lgC(A+)•C(B-)=-lgKsp=-lg(1.0×10-10)=10,故B正确;
C.0.01mol/L的盐酸滴定某浓度的氨水溶液,滴定终时生成氯化铵,溶液呈酸性,此时离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),由于离子浓度与pC成反比,则:pC(Cl-)<pC(NH4+)<pC(H+)<pC(OH-),故C错误;
D.根据电荷守恒可知c(Na+)+c(H+)=c(OH)-+c(CH3COO-),则-lg[c(Na+)+c(H+)]=-lg[c(OH)-+c(CH3COO-)],不一定满足c(Na+)+c(H+)=c(OH)-+c(CH3COO-),故D错误;
故选B.
点评 本题考查Kw、Ksp影响因素及计算、离子浓度大小比较等知识,明确题干信息的含义为解答关键,重在考查知识迁移能力,培养了学生的分析、理解能力及灵活应用所学知识的能力.

 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案| A. | 释放能量 | |
| B. | 储存能量 | |
| C. | 反应物的总能量低于生成物的总能量 | |
| D. | 反应物的总能量高于生成物的总能量 |
| A. | 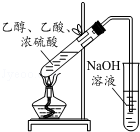 实验室中制取少量的乙酸乙酯 | |
| B. | 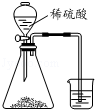 比较硫、碳、硅三种元素的非金属性强弱 | |
| C. | 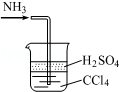 处理尾气 | |
| D. | 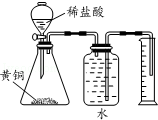 测定黄铜(Cu、Zn合金)中Zn 的含量 |

| A. | 该温度下,加入NaHSO4可能引起由b向a的变化 | |
| B. | 该温度下,pH=2的盐酸与pH=12的氢氧化钠溶液等体积混合,所得溶液显中性 | |
| C. | 该温度下,加入Na2CO3溶液能引起b向c的变化 | |
| D. | 降低温度可能引起b向d的变化 |
| 实验目的 | 实验操作 | |
| A | 验证淀粉已水解 | 在淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的银氨溶液并水浴加热 |
| B | 比较醋酸和次氯酸的酸性强弱 | 用PH试纸测定0.1mol•L-1醋酸钠溶液和0.01mol•L-1次氯酸钠溶液的PH |
| C | 证明Cl2的氧化性比Br2氧化性强 | 0.1mol•L-1 NaBr溶液中加入适量的新制氯水,反应后再加入适量的四氯化碳,振荡,观察下层液体的颜色 |
| D | 除去苯中混有的少量苯酚 | 向其中加入适量的溴水再过滤 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 氨气分子呈正四面体空间构型 | B. | CS2分子的结构式:S═C═S | ||
| C. | S2-的结构示意图: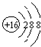 | D. | 氯化铵的电子式 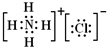 |
| A. | 用量筒量取30mL溶液 | B. | 用四氯化碳萃取碘水中的碘 | ||
| C. | 用托盘天平称取2.5g固体 | D. | 用温度计代替玻璃棒搅拌溶液 |
| A. | 面粉-淀粉 | B. | 牛肉-蛋白质 | C. | 桔子-维生素 | D. | 梅子蜜饯-防腐剂 |
| A. | 很多水果具有酸味,因此在化学上称为酸性食物 | |
| B. | 为增强婴儿的食欲,应在婴儿食品中多加着色剂 | |
| C. | 多吃含钙丰富的豆腐可预防骨质疏松 | |
| D. | 为摄取足够的蛋白质,应多吃肉、少吃豆制品 |