题目内容
7.一定温度下,水溶液中H+和OH-的浓度变化如图所示,下列说法不正确的是( )
| A. | 该温度下,加入NaHSO4可能引起由b向a的变化 | |
| B. | 该温度下,pH=2的盐酸与pH=12的氢氧化钠溶液等体积混合,所得溶液显中性 | |
| C. | 该温度下,加入Na2CO3溶液能引起b向c的变化 | |
| D. | 降低温度可能引起b向d的变化 |
分析 A.硫酸氢钠为强酸的酸式盐,电离出氢离子使溶液酸性增强,碱性减弱;
B.Kw=c(H+)×c(OH-),该温度下,水的离子积常数为10-12;
C.Na2CO3为强碱弱酸盐,水解呈碱性,溶液碱性增强;
D.温度改变水的离子积的改变.
解答 解:A.NaHSO4是强酸强碱酸式盐,属强电解质,完全电离,电离方程式为:NaHSO4=Na++H++SO42-,电离出氢离子使溶液酸性增强,碱性减弱,可能引起由b向a的变化,故A正确;
B.pH=2的盐酸中氢离子浓度=10-2mol/L,根据图示该温度下,Kw=c(H+)×c(OH-)=10-6×10-6=10-12,pH=12的氢氧化钠溶液c(OH-)=$\frac{1{0}^{-12}}{10-12}$=1mol/L,等体积混合,碱过量,溶液呈碱性,故B错误;
C.碳酸钠多元弱酸的酸式盐,分步水解,水解的离子方程式:CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,溶液碱性增强能引起b向c的变化,故C正确;
D.水的电离为吸热,降低温度,水的电离常数减小,b向d水溶液中H+和OH-的浓度都减小,所以符合降低温度引起的变化,所以降低温度可能引起b向d的变化,故D正确;
故选B.
点评 本题考查了水的电离及水的离子积,题目难度中等,注意水的电离是吸热反应,溶液的酸碱性取决于氢离子和氢氧根离子浓度相对大小,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
相关题目
15.下列说法不正确的是( )
| A. | 在人类研究物质微观结构的过程中,先后使用了光学显微镜、电子显微镜、扫描隧道显微镜三种不同层次的观测仪器 | |
| B. | 石墨烯是从石墨材料中剥离出来、由碳原子构成的只有一层原子厚度的二维晶体,该晶体属于烯烃类物质 | |
| C. | 生物质能来源于植物及其加工产品所贮存的能量,其主要利用形式有:直接燃烧、生物化学转化、热化学转换等 | |
| D. | 使用可再生资源、提高原子经济性、推广利用二氧化碳与环氧丙烷生成的可降解高聚物等都是绿色化学的内容 |
2.下列说法正确的是( )
| A. | 126C、136C、146C三种核素互为同素异形体 | |
| B. | 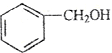 和 和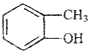 的分子式相同,化学性质也相同 的分子式相同,化学性质也相同 | |
| C. | 等质量的甲烷按a,b两种途径完全转化,途径a比途径b消耗更多的O2 途径a:CH$→_{催化剂}^{H_{2}O}$CO+H2$→_{燃烧}^{O_{2}}$CO2+H2O;途径b:CH4$→_{燃烧}^{O_{2}}$CO2+H2O | |
| D. | 铝热反应实验说明:在一定条件下铝的还原性强于很多难熔金属 |
12.下列离子方程式与所述事实相符且正确的是( )
| A. | 在含3.2amolHNO3的稀溶液中,加入2amol铁粉:5Fe+4NO3-+16H+═3Fe2++2Fe3++4NO↑+8H2O | |
| B. | 向Mg(HCO3)2溶液中加入过量的NaOH溶液:Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O | |
| C. | 泡沫灭火器灭火时发生的反应:2Al3++3CO32-+H2O═2Al(OH)3↓+3CO2↑ | |
| D. | 将AgCl白色沉淀加入Na2S溶液中反应:2AgCl+S2-═Ag2S↓+2Cl- |
19.pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol•L-1,则该溶液中溶质的pC=3.下列说法正确的是( )
| A. | 某温度下,任何电解质的水溶液中:pC(H+)+pC(OH-)=14 | |
| B. | 某温度下,AB难溶性离子化合物的Ksp=1.0×10-10,其饱和溶液中:pC(A+)+pC(B-)=10 | |
| C. | 0.01mol/L的盐酸滴定某浓度的氨水溶液,滴定终时:pC(Cl-)>pC(NH4+)>pC(H+)>pC(OH-) | |
| D. | 0.01mol/L的醋酸钠溶液中:pC(Na+)+pC(H+)=pC(OH)-+pC(CH3COO-) |
16.铜锌原电池的装置如图所示,下列说法正确的是( )


| A. | 锌电极上发生还原反应 | |
| B. | 铜电极上发生氧化反应 | |
| C. | 锌片和铜片上都有氧气产生 | |
| D. | 原电池工作一段时间后溶液的c(H+)减小 |
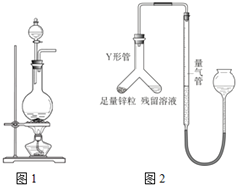 实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图所示).
实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图所示).
 我国的能源主要来源于燃煤,煤燃烧产生的烟气直接排放会引起严重的环境问题.将烟气通过石灰石浆液的脱硫装置可以除去85%~90%的SO2,且最终会生成硫酸钙,将硫酸钙与甲烷通过循环燃烧装置的燃料反应器进行反应,生产出几乎不含杂质的二氧化碳,减少碳排放,其装置如图所示.
我国的能源主要来源于燃煤,煤燃烧产生的烟气直接排放会引起严重的环境问题.将烟气通过石灰石浆液的脱硫装置可以除去85%~90%的SO2,且最终会生成硫酸钙,将硫酸钙与甲烷通过循环燃烧装置的燃料反应器进行反应,生产出几乎不含杂质的二氧化碳,减少碳排放,其装置如图所示.