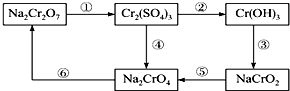
题目内容
10.下列实验操作不正确的是( )| A. | 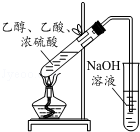 实验室中制取少量的乙酸乙酯 | |
| B. | 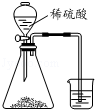 比较硫、碳、硅三种元素的非金属性强弱 | |
| C. | 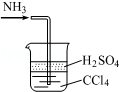 处理尾气 | |
| D. | 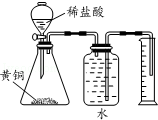 测定黄铜(Cu、Zn合金)中Zn 的含量 |
分析 A.乙酸乙酯与NaOH反应;
B.发生强酸制取弱酸的反应;
C.四氯化碳可隔绝气体与硫酸;
D.Zn与盐酸反应,Cu不能,排水法测定氢气的体积.
解答 解:A.乙酸乙酯在碱性条件下水解,应用饱和碳酸钠溶液吸收,且导管不能插入液面下,故A错误;
B.若锥形瓶中生成气体,说明硫酸的酸性比碳酸强,烧杯中生成白色沉淀,说明碳酸的酸性比硅酸强,最高价氧化物对应水化物酸性越强,则对应元素的非金属性越强,
因此比较硫、碳、硅非金属性强弱的实验方案合理,故B正确;
C.氨气易溶于硫酸,难溶于四氯化碳,四氯化碳的密度比硫酸溶液大,导管口伸入下层液体可以防止倒吸,逸出的氨气被稀硫酸完全吸收生成铵盐,故C正确;
D.锌是氢前金属,铜是氢后金属,前者与稀盐酸发生置换反应,生成的氢气难溶于水,水还能除去氢气中混有的氯化氢,排水量气法收集氢气,根据氢气的体积可以计算完全反应的锌的质量,进而可以求黄铜中锌的含量,故D正确;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、反应原理、实验装置的作用、基本技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
20.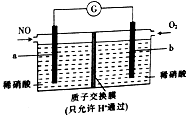 用NO生产硝酸,可以有效消除污染,其原理如图所示.下列说法正确的是( )
用NO生产硝酸,可以有效消除污染,其原理如图所示.下列说法正确的是( )
 用NO生产硝酸,可以有效消除污染,其原理如图所示.下列说法正确的是( )
用NO生产硝酸,可以有效消除污染,其原理如图所示.下列说法正确的是( )| A. | a极是该电极的正极 | |
| B. | 电流由a极经导线流向b极 | |
| C. | a极的电极反应式为NO-3e-+2H2O═NO3-+4H+ | |
| D. | 若消耗2.24L(标准状况下)氧气,则会有0.4 molH+通过质子交换膜进入a极区 |
1.二甲苯与苯类似,都能与H2发生加成反应.1,2二甲苯(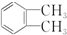 )加氢产物1,2二甲基环己烷(
)加氢产物1,2二甲基环己烷( )的一氯代产物有(不考虑立体异构)( )
)的一氯代产物有(不考虑立体异构)( )
 )加氢产物1,2二甲基环己烷(
)加氢产物1,2二甲基环己烷( )的一氯代产物有(不考虑立体异构)( )
)的一氯代产物有(不考虑立体异构)( )| A. | 5种 | B. | 6种 | C. | 3种 | D. | 4种 |
5. 某学生欲通过实验方法验证 Fe2+的性质.
某学生欲通过实验方法验证 Fe2+的性质.
(1)该同学在实验前,依据Fe2+的还原性,填写了表格.
依照表中操作,该同学进行实验,观察到液面上方气体逐渐变为红棕色,但试管中溶液颜色却变为深棕色.为了进一步探究溶液变为深棕色的原因,该同学进行如下实验.
(2)向原新制FeSO4溶液和反应溶液后溶液中均加入KSCN溶液,前者不变红色,后者变红.该现象的结论是Fe2+被硝酸氧化为Fe3+.
(3)该同学通过查阅资料,认为溶液的深棕色可能是NO2或NO与溶液中Fe3+或Fe2+发生反应而得到的.为此他利用如图装置(气密性已检验,尾气处理装置略)进行探究.
ⅰ.打开活塞a、关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液并无明显变化.
ⅱ.打开活塞b、关闭a,一段时间后再停止甲中反应.ⅲ为与ⅰ中实验进行对照,更换丙丁后,使甲中反应继续,观察到的现象与步骤ⅰ中相同.
①铜与足量浓硝酸反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O;
②装置乙的作用是使NO2转化为NO;
③步骤ⅱ目的是排出乙右侧装置中残留的NO2;
④该实验可得出的结论是溶液的深棕色是由Fe2+与NO或NO2作用得到.
(4)该同学重新进行(1)中实验,观察到了预期现象,其实验操作是向盛有浓硝酸的试管中滴入数滴新制FeSO4溶液,振荡.
 某学生欲通过实验方法验证 Fe2+的性质.
某学生欲通过实验方法验证 Fe2+的性质.(1)该同学在实验前,依据Fe2+的还原性,填写了表格.
| 实验操作 | 预期现象 | 反应的离子方程式 |
| 向盛有新制FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红综色气体,溶液颜色逐渐变黄 | Fe2++NO3-+2H+═Fe3++NO2↑+H2O |
(2)向原新制FeSO4溶液和反应溶液后溶液中均加入KSCN溶液,前者不变红色,后者变红.该现象的结论是Fe2+被硝酸氧化为Fe3+.
(3)该同学通过查阅资料,认为溶液的深棕色可能是NO2或NO与溶液中Fe3+或Fe2+发生反应而得到的.为此他利用如图装置(气密性已检验,尾气处理装置略)进行探究.
ⅰ.打开活塞a、关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液并无明显变化.
ⅱ.打开活塞b、关闭a,一段时间后再停止甲中反应.ⅲ为与ⅰ中实验进行对照,更换丙丁后,使甲中反应继续,观察到的现象与步骤ⅰ中相同.
①铜与足量浓硝酸反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O;
②装置乙的作用是使NO2转化为NO;
③步骤ⅱ目的是排出乙右侧装置中残留的NO2;
④该实验可得出的结论是溶液的深棕色是由Fe2+与NO或NO2作用得到.
(4)该同学重新进行(1)中实验,观察到了预期现象,其实验操作是向盛有浓硝酸的试管中滴入数滴新制FeSO4溶液,振荡.
15.下列说法不正确的是( )
| A. | 在人类研究物质微观结构的过程中,先后使用了光学显微镜、电子显微镜、扫描隧道显微镜三种不同层次的观测仪器 | |
| B. | 石墨烯是从石墨材料中剥离出来、由碳原子构成的只有一层原子厚度的二维晶体,该晶体属于烯烃类物质 | |
| C. | 生物质能来源于植物及其加工产品所贮存的能量,其主要利用形式有:直接燃烧、生物化学转化、热化学转换等 | |
| D. | 使用可再生资源、提高原子经济性、推广利用二氧化碳与环氧丙烷生成的可降解高聚物等都是绿色化学的内容 |
2.下列说法正确的是( )
| A. | 126C、136C、146C三种核素互为同素异形体 | |
| B. | 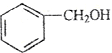 和 和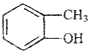 的分子式相同,化学性质也相同 的分子式相同,化学性质也相同 | |
| C. | 等质量的甲烷按a,b两种途径完全转化,途径a比途径b消耗更多的O2 途径a:CH$→_{催化剂}^{H_{2}O}$CO+H2$→_{燃烧}^{O_{2}}$CO2+H2O;途径b:CH4$→_{燃烧}^{O_{2}}$CO2+H2O | |
| D. | 铝热反应实验说明:在一定条件下铝的还原性强于很多难熔金属 |
19.pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol•L-1,则该溶液中溶质的pC=3.下列说法正确的是( )
| A. | 某温度下,任何电解质的水溶液中:pC(H+)+pC(OH-)=14 | |
| B. | 某温度下,AB难溶性离子化合物的Ksp=1.0×10-10,其饱和溶液中:pC(A+)+pC(B-)=10 | |
| C. | 0.01mol/L的盐酸滴定某浓度的氨水溶液,滴定终时:pC(Cl-)>pC(NH4+)>pC(H+)>pC(OH-) | |
| D. | 0.01mol/L的醋酸钠溶液中:pC(Na+)+pC(H+)=pC(OH)-+pC(CH3COO-) |
20.将相同质量的铜分别与足量的浓硝酸、稀硝酸反应,下列叙述正确的是( )
| A. | 硝酸浓度越大消耗的硝酸越少,产生的有毒气体也越少 | |
| B. | 反应中转移的电子总数稀硝酸少 | |
| C. | 试管内壁上的铜用浓硝酸除好,因反应速率快 | |
| D. | 两者用排水法收集的气体的体积相同 |