题目内容
7.用相关知识解答:(1)基态氮原子的L层电子排布图为
 ,与N3-互为等电子体的分子为N2O(写一种);
,与N3-互为等电子体的分子为N2O(写一种);(2)一定压强,将HF和HCl混合气体降温时,首先液化的物质是HF;
(3)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断是CrO2Cl2非极性(填“极性”或“非极性”)分子;
(4)现有Ti3+的配合物[TiCl(H2O)5]Cl2•H2O,该配合物的配体是H2O、Cl-,配位数是6.
分析 (1)N原子2s轨道容纳2个电子,且自旋方向相反,2p能级3个轨道各容纳1个电子,且自旋方向相同;原子个数相等、价电子数相等的微粒互为等电子体;
(2)HF分子之间有氢键,沸点较高;
(3)根据相似相溶的原理,非极分子易溶于非极性溶剂;
(4)配合物也叫络合物,为一类具有特征化学结构的化合物,由中心原子或离子(统称中心原子)和围绕它的称为配位体(简称配体)的分子或离子,完全或部分由配位键结合形成,配位体:提供孤电子对的分子或离子;配位原子:配体中,提供电子对的原子;中心原子、金属原子:一般指接受电子对的原子;配位数:中心原子周围的配位原子个数;
解答 解:(1)N原子2s轨道容纳2个电子,且自旋方向相反,2p能级3个轨道各容纳1个电子,且自旋方向相同,故基态氮原子的L层电子排布图为: ,
,
原子个数相等、价电子数相等的微粒互为等电子体,N3-中原子个数是3、价电子数是15,所以其等电子体有N2O、CO2、CS2;故答案为: ; N2O;
; N2O;
(2))HF分子之间有氢键,沸点较高,所以首先液化的物质是HF,故答案为:HF;
(3)根据相似相溶的原理,非极分子易溶于非极性溶剂,能与非极性溶剂CCl4、CS2等互溶,说明CrO2Cl2 是非极性分子,故答案为:非极性;
(4)[TiCl(H2O)5]Cl2•H2O中,中心离子是Ti3+,提供空轨道接受孤对电子,H2O、Cl-提供孤电子对为配体,2个氨气分子,所以配位数为6,外界是Cl-,内界是:[TiCl(H2O)5]2+,
故答案为:H2O、Cl-;6.
点评 本题考查配合物的成键情况,注意配体、中心离子、外界离子以及配位数的判断,把握相关概念,相似相溶判断分子的极性,题目难度中等.

练习册系列答案
相关题目
14.除去下列杂质(括号内的物质),下列做法不正确的是( )
| A. | NaCl固体(CaCl2):溶解,加Na2CO3溶液、过滤后加适量盐酸,最后蒸发结晶 | |
| B. | KCl固体(MnO2):溶解、过滤、蒸发结晶 | |
| C. | NaCl溶液(I2):加酒精,萃取、分液 | |
| D. | KNO3溶液(I2):加四氯化碳,萃取、分液 |
15.现有三组分散系:①汽油和氯化钠溶液 ②酒精的水溶液 ③碘单质的水溶液,分离以上各混合液的正确方法依次是( )
| A. | 分液、萃取、蒸馏 | B. | 分液、蒸馏、萃取 | C. | 萃取、蒸馏、分液 | D. | 蒸馏、萃取、分液 |
12.葡萄糖分子中含醛基(-CHO),能与银氨溶液发生银镜反应生成光亮的银.有机物C8H5O3Br的同分异构体中,苯环上含有3个取代基且能发生银镜反应的结构共有( )(不考虑立体异构体)
| A. | 8种 | B. | 10种 | C. | 11种 | D. | 13种 |
19.性质决定用途,下列物质的用途中,利用其物理性质的是( )
| A. | 干冰用作冷冻剂 | B. | 硫酸用于处理碱性废液 | ||
| C. | 氧气用于气焊 | D. | 生石灰用作干燥剂 |
17.下列实验操作中错误的是( )
| A. | 蒸发结晶操作时,当有大量晶体析出时停止加热,用余热蒸干 | |
| B. | 蒸馏操作时,应使温度计水银球插入液态混合物中 | |
| C. | 分液操作时,分液漏斗中下层液体从下口流出,上层液体从上口倒出 | |
| D. | 萃取操作时,萃取剂要和原溶剂互不相溶,且不能与溶质和溶剂反应 |

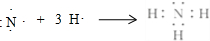 ;
; .
.