题目内容
下列有关阿伏加德罗常数(NA)的说法正确的是( )
| A、32 g O2所含的原子数目为NA |
| B、1 mol氢约含有6.02×1023个微粒 |
| C、标准状况下,2NA 个H2O的体积约为44.8 L |
| D、标准状况下,22.4 L CH4和H2的混合气体中含有NA个分子 |
考点:阿伏加德罗常数
专题:
分析:A、根据氧原子的摩尔质量为16g/mol来计算;
B、1mol氢指代不明;
C、标况下,水为液态;
D、根据标准状况下气体摩尔体积计算出混合气体的物质的量及分子数;
B、1mol氢指代不明;
C、标况下,水为液态;
D、根据标准状况下气体摩尔体积计算出混合气体的物质的量及分子数;
解答:
解:A、氧原子的摩尔质量为16g/mol,故32g氧气中含有的氧原子的物质的量n=
=2mol,个数为2NA个,故A错误;
B、1 mol氢指代不明,不能确定物质的种类,故B错误;
C、标况下,水为液态,故C错误;
D、标准状况下,气体摩尔体积为22.4L/mol,所以22.4 L任意比的氢气和甲烷的混合气体的物质的量为1mol,含有的分子总数均为NA,故D正确;
故选D.
| 32g |
| 16g/mol |
B、1 mol氢指代不明,不能确定物质的种类,故B错误;
C、标况下,水为液态,故C错误;
D、标准状况下,气体摩尔体积为22.4L/mol,所以22.4 L任意比的氢气和甲烷的混合气体的物质的量为1mol,含有的分子总数均为NA,故D正确;
故选D.
点评:本题考查了阿伏伽德罗常数的有关计算,掌握公式的使用和物质的结构、状态是解题关键,难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A、标准状况下,1.8 g H2O所含有的质子数为NA |
| B、1 L 1 mol/L的Na2CO3溶液中含有的CO32-数目为NA |
| C、25℃时,1 L pH=13的 Ba(OH)2溶液中含有的OH-数目为0.2NA |
| D、标准状况下,2.24 L 氯气与过量的氢氧化钠溶液完全反应转移的电子数为0.2NA |
某探究小组利用丙酮的溴代反应(CH3COCH3+Br2
CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系.反应速率v (Br2)通过测定溴的颜色消失所需的时间来确定.在一定温度下,获得如下实验数据:分析实验数据所得出的结论不正确的是( )
| HCl |
| 实验 序号 | 初始浓度 c/mol?L-1 | 溴颜色消失 所需时间 t/s | ||
| CH3COCH3 | HCl | Br2 | ||
| ① | 0.8 | 0.2 | 0.001 | 290 |
| ② | 1.6 | 0.2 | 0.001 | 145 |
| ③ | 0.8 | 0.4 | 0.001 | 145 |
| ④ | 0.8 | 0.2 | 0.001 | 580 |
| A、v (Br2)与c(CH3COCH3)成正比 |
| B、增大c(Br2),v (Br2)变小 |
| C、增大c(HCl),v (Br2)增大 |
| D、实验②和③的v (Br2)相等 |
下列溶液,一定呈中性的是( )
| A、由等体积、等物质的量浓度的一元酸跟NaOH溶液混合后所形成的溶液 |
| B、c(H+)=1.0×10-7mol?L-1的溶液 |
| C、pH=14-pOH的溶液 |
| D、pH=pOH的溶液 |
下列化学用语正确的是( )
| A、氟化氢的电子式:H:F |
| B、乙醇的分子式:CH3CH2OH |
C、硫原子的结构示意图: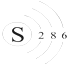 |
| D、Na2O2中即含有离子键,又含有非极性共价键 |
 氮是地球上极为丰富的元素.
氮是地球上极为丰富的元素. 1000℃时,硫酸钠可与氢气发生反应:Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g).请回答下列问题:
1000℃时,硫酸钠可与氢气发生反应:Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g).请回答下列问题: