题目内容
正确书写有关离子方程式
(1)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式: ;
(2)向Ba(OH)2溶液中逐滴加入NaHSO4溶液至Ba2+恰好完全沉淀,请写出发生反应的离子方程式: ;在以上溶液继续滴加NaHSO4溶液,请写出此步反应的离子方程式: .
(1)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式:
(2)向Ba(OH)2溶液中逐滴加入NaHSO4溶液至Ba2+恰好完全沉淀,请写出发生反应的离子方程式:
考点:离子方程式的书写
专题:离子反应专题
分析:(1)NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,反应生成硫酸钡、硫酸钠和水;
(2)向Ba(OH)2溶液中逐滴加入NaHSO4溶液至Ba2+恰好完全沉淀,反应生成硫酸钡、氢氧化钠和水,继续滴加NaHSO4溶液,氢离子与氢氧根离子反应生成水.
(2)向Ba(OH)2溶液中逐滴加入NaHSO4溶液至Ba2+恰好完全沉淀,反应生成硫酸钡、氢氧化钠和水,继续滴加NaHSO4溶液,氢离子与氢氧根离子反应生成水.
解答:
解:(1)NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,反应生成硫酸钡、硫酸钠和水,离子方程式为:2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O;
故答案为:2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O;
(2)向Ba(OH)2溶液中逐滴加入NaHSO4溶液至Ba2+恰好完全沉淀,反应生成硫酸钡、氢氧化钠和水,离子方程式为:H++SO42-+OH-+Ba2+=BaSO4↓+H2O;继续滴加NaHSO4溶液,氢离子与氢氧根离子反应生成水,离子方程式为:H++OH-=H2O;
故答案为:H++SO42-+OH-+Ba2+=BaSO4↓+H2O;H++OH-=H2O.
故答案为:2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O;
(2)向Ba(OH)2溶液中逐滴加入NaHSO4溶液至Ba2+恰好完全沉淀,反应生成硫酸钡、氢氧化钠和水,离子方程式为:H++SO42-+OH-+Ba2+=BaSO4↓+H2O;继续滴加NaHSO4溶液,氢离子与氢氧根离子反应生成水,离子方程式为:H++OH-=H2O;
故答案为:H++SO42-+OH-+Ba2+=BaSO4↓+H2O;H++OH-=H2O.
点评:本题考查了离子方程式的书写,明确化学反应的实质、掌握离子方程式书写的方法是解题关键,注意反应物用量对反应的影响,题目难度不大.

练习册系列答案
相关题目
设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A、标准状况下,1.8 g H2O所含有的质子数为NA |
| B、1 L 1 mol/L的Na2CO3溶液中含有的CO32-数目为NA |
| C、25℃时,1 L pH=13的 Ba(OH)2溶液中含有的OH-数目为0.2NA |
| D、标准状况下,2.24 L 氯气与过量的氢氧化钠溶液完全反应转移的电子数为0.2NA |
下列溶液,一定呈中性的是( )
| A、由等体积、等物质的量浓度的一元酸跟NaOH溶液混合后所形成的溶液 |
| B、c(H+)=1.0×10-7mol?L-1的溶液 |
| C、pH=14-pOH的溶液 |
| D、pH=pOH的溶液 |
下列化学用语正确的是( )
| A、氟化氢的电子式:H:F |
| B、乙醇的分子式:CH3CH2OH |
C、硫原子的结构示意图: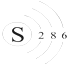 |
| D、Na2O2中即含有离子键,又含有非极性共价键 |
用NA表示阿伏加德罗常数,下列说法中错误的是( )
| A、在一定温度压强下,14 gN2所含的体积可能为11.2 L |
| B、标准状况下,足量NaOH溶液与2.24 LCl2反应,转移电子数目为0.1NA |
| C、标准状况下,11.2 LH2O中含有的电子数为5NA |
| D、加热条件下,足量Cl2与1 molFe粉充分反应,转移的电子数为3NA |
想一想:NaOH、CuSO4、CH3COOH这些物质为什么可以归为一类,下列哪些物质还可以和它们归为一类( )
| A、CO2 |
| B、HCl(气态) |
| C、Fe(OH)3胶体 |
| D、NaOH溶液 |
下列变化属于化学变化的是( )
| A、从CuSO4溶液中提取单质铜 |
| B、浓盐酸的挥发 |
| C、从浓食盐水中得到氯化钠晶体 |
| D、用CCl4萃取溴水中的溴 |