题目内容
9.工业上利用CO2和H2催化氢化可以制取甲烷.(1)已知
①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ•mol-1
②2H2(g)+O2(g)=2H2O(l)△H=-572kJ•mol-1
③H2O(g)=H2O(l)△H=-44kJ•mol-1
CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=a kJ•mol-1
据此,a=-166,利于该反应自发进行的条件是低温(选填“高温”或“低温”).
(2)在一定压强、不同温度下,两种催化剂分别催化CO2加氢甲烷化反应2h的结果如图1所示(一定温度下仅改变催化剂,其他条件不变):a、b-催化剂I; c、d-催化剂II.甲烷化选择性:指含碳产物中甲烷的物质的量分数.请据图1分析:
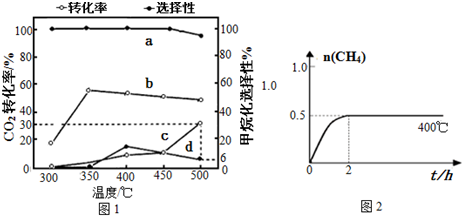
①催化剂I实验,400℃~450℃时CO2转化率下降的原因可能为温度高速率快2h已达平衡,反应放热升温平衡逆移,所以反应的CO2减
少转化率下降.
②催化剂II实验,检测密闭容器中产物发现,温度升高甲烷的选择性下降是发生了:CO2(g)+H2(g)?CO(g)+H2O(g)△H>0.若不再改变温度,提高甲烷化选择性可以采取的一个措施:改用催化剂I或加压.(写出一个合理措施即可)
(3)下列与甲烷化反应有关的描述中,正确的是A、C、D.
A.单位时间内断裂2molC=O键的同时断裂4molC-H,说明该反应已达平衡
B.催化剂Ⅰ作用下的活化能比催化剂Ⅱ的大
C.甲烷化反应在绝热的密闭容器中进行时,当容器中温度不变时说明达到平衡
D.催化剂Ⅰ下,300-450℃内,选择性保持不变的主要原因是其它副反应的速率很慢
(4)催化剂I实验,400℃时,向2L固定体积的密闭容器中通入1mol CO2和4mol H2,CH4物质的量随时间的变化趋势如图2时所示,则2h内CO2平均反应速率为0.125mol•L-1•h-1.若其他条件不变,反应在恒压条件下进行,请在图2中画出反应体系中n(CH4)随时间t变化的趋势图.
分析 (1)根据盖斯定律计算,CO2(g)+3H2(g)═CH3OH(l)+H2O(l),熵变△S<0,则反应焓变△H<0,低温下满足△H-T△S<0;
(2)①温度太高催化剂活性下降反应速率减小2h反应的CO2减少转化率下降或温度高速率快2h已达平衡,反应放热升温平衡逆移,所以反应的CO2减少转化率下降;
②若不再改变温度,改用催化剂I或加压能加快反应速率;
(3)正反应速率等于逆反应速率不等于0则平衡,变量不变则平衡;
(4)根据v=$\frac{\frac{(1-0.5)mol}{2L}}{2h}$计算;若其他条件不变,反应在恒压条件下温度高反应快,先平衡.
解答 解:(1)根据盖斯定律,CO2(g)+4H2(g)?CH4(g)+2H2O(g)等于②×2-①-③,△H=-572×2-(-890)-(-44)=-166kJ•mol-1,CO2(g)+3H2(g)═CH3OH(l)+H2O(l),熵变△S<0,则反应焓变△H<0,低温下满足△H-T△S<0,
故答案为:-166;低温;
(2)①催化剂I实验,400℃~450℃时CO2转化率下降的原因可能为温度太高催化剂活性下降反应速率减小2h反应的CO2减少转化率下降或温度高速率快2h已达平衡,反应放热升温平衡逆移,所以反应的CO2减少转化率下降,故答案为:温度高速率快2h已达平衡,反应放热升温平衡逆移,所以反应的CO2减少转化率下降;
②若不再改变温度,提高甲烷化选择性可以采取加快速率,措施为改用催化剂I或加压,故答案为:改用催化剂I或加压;
(3)下列与甲烷化反应有关的描述中,正确的是
A.单位时间内断裂2molC=O键的同时断裂4molC-H,方向相反成正比例,说明该反应已达平衡,A正确;
B.催化剂降低反应所需活化能,Ⅰ作用下的活化能比催化剂Ⅱ的小,B错误;
C.甲烷化反应在绝热的密闭容器中进行时,温度为变量,变量不变则平衡,C正确;
D.催化剂Ⅰ下,300-450℃内,选择性保持不变的主要原因是其它副反应的速率很慢,正确;
故答案为:ACD;
(4)2h甲烷变化0.5mol,CO2变化0.5mol,故v=$\frac{\frac{(1-0.5)mol}{2L}}{2h}$=0.125mol•L-1•h-1;若其他条件不变,反应在恒压条件下进行,反应体系中n(CH4)随时间t变化的趋势图为 ,故答案为:0.125mol•L-1•h-1;
,故答案为:0.125mol•L-1•h-1; .
.
点评 本题考查化学反应速率或平衡的图象和热化学反应方程式,考查计算反应速率的大小比较以及反应物转化的多少,注意把握对题目图象的分析.题目较为综合,具有一定难度.

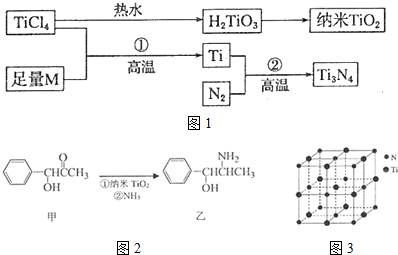
图中的M是短周期金属元素,M的部分电离能如下表:
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ•mol-1 | 738 | 1451 | 7733 | 10540 | 13630 |
(1)Ti的基态原子外围电子排布式为3d24s2;
(2)M是Mg(填元素符号),该金属晶体的堆积模型为六方最密堆积,配位数为12;
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图2所示.化合物甲的分子中采取sp2方式杂化的碳原子有7个,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为O>N>C;
(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图3所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为$\frac{4×62}{{N}_{A}×(2a×1{0}^{-10})^{3}}$g•cm-3(NA为阿伏加德罗常数的值,只列计算式).该晶体中与N原子距离相等且最近的N原子有12个;
(5)科学家通过X一射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似.则KCl、CaO、TiN三种离子晶体熔点由高到低的顺序为TiN>CaO>KCl.判断依据是:离子所带的电荷数越高,晶格能越大,熔点越高.
| A | B | C | D | |
| 污染 | 废旧热固性塑料 | 煤燃烧 | 含Hg2+的工业废水 | 生活垃圾 |
| 方法 | 粉碎作为填充剂 | 煤中加入适量石灰石 | 加入Na2S溶液 | 焚烧发电 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 容量瓶、量筒和滴定管上都标有使用温度,容量瓶无“0”刻度,量筒、滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| B. | 向3支试管中各加入2mL 0.1mol•L-1酸性高锰酸钾溶液和2mL 0.01mol•L-1 H2C2O4溶液,将它们分别置于冰水、室温下、80℃热水中,观察比较褪色快慢 | |
| C. | 皂化反应结束后的混合液中加入饱和食盐水,再通过分液操作分离出硬脂酸钠 | |
| D. | 为保证实验安全,金属钠切割下来的表层物质应放回原试剂瓶,不能在研钵中研磨氯酸钾或硝酸钾 |
| A. | CH3CH(CH2CH3)2的系统命名为3-甲基戊烷,与CH3CH2CH(CH3)CH2CH3互为同系物 | |
| B. | 乙烯、氯乙烯和聚氯乙烯都能因发生加成反应而使溴水褪色 | |
| C. | 用甘氨酸(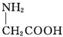 )和丙氨酸( )和丙氨酸(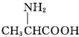 )的混合物在一定条件下可形成四种链状二肽 )的混合物在一定条件下可形成四种链状二肽 | |
| D. | 甲苯(C7H8)和甘油(C3H8O3)混合物,当总质量一定时,随$\frac{n({C}_{7}{H}_{8})}{n({C}_{3}{H}_{8}{O}_{3})}$比值增大,耗氧量和生成水的量都增大. |
| A. | 使酚酞呈红色的溶液:Na+、NO3-、Ba2+、Br- | |
| B. | 加水稀释pH减小的溶液:K+、Al3+、Cl-、CH3COO- | |
| C. | 含有大量Fe(NO3)2的溶液:NH4+、H+、SO42-、I- | |
| D. | c(OH-)<$\sqrt{{K}_{w}}$的溶液:ClO-、NO3-、Na+、Ca2+ |
 .
.
 ;
; .
.