题目内容
8.汽车安全气囊是行车安全的重要保障.当车辆发生碰撞的瞬间,安全装置通电点火使其中的固体粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客免受伤害.为研究安全气囊工作的化学原理,取安全装置中的固体粉末进行实验.经组成分析,确定该粉末仅含Na、Fe、N、O四种元素.水溶性试验表明,固体粉末部分溶解.经检测,可溶物为化合物甲;不溶物为红棕色固体,可溶于盐酸.取13.0g化合物甲,加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72L.单质乙在高温隔绝空气的条件下与不溶物红棕色粉末反应生成化合物丙和另一种单质.化合物丙与空气接触可转化为可溶性盐.请回答下列问题:
(1)甲的化学式为NaN3.
(2)若丙在空气中转化为碳酸氢盐,则反应的化学方程式为Na2O+2CO2+H2O=2NaHCO3
(3)单质乙与红棕色粉末发生反应的化学方程式为6Na+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3Na2O安全气囊中红棕色粉末的作用是避免分解产生的钠可能产生危害
(4)以下物质中,有可能作为安全气囊中红棕色粉末替代品的是B
A.KCl B.CuOC.Na2S
(5)设计一个实验方案,探究化合物丙与空气接触后生成可溶性盐的成分(不考虑结晶水合物)可溶性盐的成分可能是Na2CO3或NaHCO3或Na2CO3与NaHCO3的混合物.准确称取一定量的生成物,加热至恒重后,如试样无失重,则为Na2CO3;如加热后失重,根据失重的量在试样总质量中的比例,即可推断出试样为NaHCO3或Na2CO3与NaHCO3的混合物.
分析 (1)根据题干信息推导出甲、乙、丙三种物质,粉末仅含Na、Fe、N、O四种元素.水溶性试验表明,固体粉末部分溶解.经检测,可溶物为化合物甲;不溶物为红棕色固体,可溶于盐酸说明为氧化铁,在四种元素组成的单质中,可以在高温隔绝空气的条件下与Fe2O3反应的就只有金属钠了,因此单质乙是钠,化合物甲是由Na和N元素组成,由分解的甲的质量和产生的氮气体积确定甲的分子式;
(2)根据物质的性质来书写化学方程式,因为丙是在高温隔绝空气的条件下生成的,在根据丙的性质可知丙只能是Na2O;
(3)根据单质和红棕色粉末发生的置换反应来分析,钠和氧化铁发生的置换反应生成铁和氧化钠,安全气囊中氧化铁粉末的作用是消耗产生的活泼的钠;
(4)根据红棕色粉末氧化铁的作用来寻找可替代的物质,需要和钠发生反应;
(5)根据可溶盐的可能组成情况结合盐的性质进行检验,氧化钠跟空气接触所得的可溶性的盐成分可能是Na2CO3,或NaHCO3,或Na2CO3与NaHCO3混合物,依据碳酸氢钠受热分解的性质设计实验检验.
解答 解:(1)Na、Fe、N、O四种元素组成的化合物中为红棕色且可溶于盐酸的只有Fe2O3,在四种元素组成的单质中,可以在高温隔绝空气的条件下与Fe2O3反应的就只有金属钠了,因此单质乙是钠,化合物甲是由Na和N元素组成,13.0g化合物甲,加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72L,即0.3mol,经计算知Na和N的原子个数比是1:3,所以化合物甲的化学式为NaN3,是一种离子化合物,故填:NaN3,
故答案为:NaN3;
(2)因为丙是在高温隔绝空气的条件下生成的,在根据丙的性质可知丙只能是Na2O而不是Na2O2,反应的化学方程式为:Na2O+2CO2+H2O=2NaHCO3,故填:Na2O+2CO2+H2O=2NaHCO3,
故答案为:Na2O+2CO2+H2O=2NaHCO3;
(3)钠和氧化铁发生的置换反应方程式为:6Na+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3Na2O,所以安全气囊中氧化铁粉末的作用是消耗产生的活泼的钠,避免分解产生的金属钠可能产生的危害,故填:6Na+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3Na2O、避免分解产生的金属钠可能产生的危害,
故答案为:6Na+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3Na2O;避免分解产生的钠可能产生危害;
(4)安全气囊中氧化铁粉末的作用是消耗产生的活泼的钠,硝酸钾本身受热分解产生氧气,可以和金属钠反应,选项中能和钠反应的还有氧化铜,故选B,
故答案为:B;
(5)氧化钠跟空气接触所得的可溶性的盐成分可能是Na2CO3,或NaHCO3,或Na2CO3与NaHCO3混合物,碳酸氢钠受热容易分解,碳酸钠受热稳定,故可以用加热的办法来确定成分,故填:可溶性盐的成分可能是Na2CO3,或NaHCO3,或Na2CO3与NaHCO3混合物;准确称取一定量的生成物.加热至恒重后,如果试样无失重,则为Na2CO3;如加热后失重,根据失重的量在试样总质量中的比例,即可推断出试样为NaHCO3,或Na2CO3与NaHCO3混合物,
故答案为:可溶性盐的成分可能是Na2CO3或NaHCO3或Na2CO3与NaHCO3的混合物.准确称取一定量的生成物,加热至恒重后,如试样无失重,则为Na2CO3;如加热后失重,根据失重的量在试样总质量中的比例,即可推断出试样为NaHCO3或Na2CO3与NaHCO3的混合物;
点评 本题以推断题的形式考查学生元素和化合物的知识,是一道综合知识题目,难度较大.

 小学期末标准试卷系列答案
小学期末标准试卷系列答案| A. | 等浓度的①(NH4)2SO4溶液、②NH4HCO3溶液、③NH4Cl溶液中的c(NH4+):①>③>② | |
| B. | 等体积pH=a的醋酸与pH=b的NaOH溶液(a+b=14)充分混合时,可能有:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | 已知Ka(HClO)=3.0×10-8,Ka(HCN)=6.2×10-10,等体积、等浓度的NaClO、NaCN溶液中,前者中的离子总数小于后者中的离子总数 | |
| D. | 向20mL氨水中加入10mL等浓度的盐酸,有c(NH4+)-c(NH3•H2O)=2[c(OH-)-c(H+)] |
| A. | 在中和滴定实验中,锥形瓶须用待测液润洗 | |
| B. | 用广泛pH试纸测得某溶液的pH为2.3 | |
| C. | 用标准盐酸溶液滴定未知浓度NaOH溶液时,若滴定前滴定管尖嘴处有气泡未排出而滴定后消失,则能使所测结果偏高 | |
| D. | 滴定时可将KMnO4溶液装在碱式滴定管中 |
Ⅰ.CaCO3(s)?CO2(g)+CaO(s)△H=+178.2kJ/mol
Ⅱ.SO2(g)+CaO(s)?CaSO3(s)△H=-402kJ/mol
Ⅲ.2CaSO3(s)+O2(g)+4H2O(l)?2[CaSO4•2H2O](s)△H=-234.2kJ/mol
(1)试写出由石灰石、二氧化硫、氧气和水反应生成生石膏的热化学方程式2CaCO3(s)+O2(g)+2SO2(g)+4H2O(l)?2[CaSO4.2H2O](s)+2CO2(g)△H=-681.8kJ/mol.
(2)反应Ⅱ为烟气除硫的关键,取相同用量的反应物在3种不同的容器中进行该反应,A容器保持恒温恒压,B容器保持恒温恒容,C容器保持恒容绝热,且初始时3个容器的容积和温度均相同,下列说法正确的是ad
a.3个容器中SO2的转化率的大小顺序:aA>aB>aC
b.当A容器内气体的平均摩尔质量不变时,说明反应处于化学平衡状态
c.A、B两个容器达到平衡所用的时间:tA>tB
d.当C容器内平衡常数不变时,说明该反应处于化学平衡状态
(3)依据上述反应Ⅱ来除硫,将一定量的烟气压缩到一个20L的容器中,测得不同温度下,容器内SO2的质量(mg)如下表
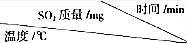 | 0 | 20 | 40 | 60 | 80 | 100 | 120 |
| T1 | 2100 | 1052 | 540 | 199 | 8.7 | 0.06 | 0.06 |
| T2 | 2100 | 869 | 242 | x | x | x | x |
②若其它条件都相同,则T1>T2(填“>”、“<”或“=”,下同);x<0.06.
③在T2温度下,若平衡后将容器的容积压缩为10L,则新平衡时SO2的浓度=原平衡时SO2的浓度(填“>”、“<”或“=”),理由是该反应的平衡常数表达式为k=$\frac{1}{c(S{O}_{2})}$,温度不变,平衡常数不变,所以浓度相等.

(1)将铅块制成铅花的目的是增大与酸的接触面积,加快溶解反应速率.
(2)31.05g铅花用5.00mol•L-1的硝酸溶解,至少需消耗5.00mol•L-1硝酸80mL.
(3)取一定质量(CH3COO)2Pb•nH2O样品在N2气氛中加热,测得样品固体残留率)($\frac{固体样品的剩余质量}{固体样品的起始质量}$×100%)随温度的变化如图2所示(已知:样品在75℃时已完全失去结晶水).

①(CH3COO)2Pb•nH2O中结晶水数目n=3(填整数).
②100~200℃间分解产物为铅的氧化物和一种有机物,则该有机物为C4H6O3(写分子式).
(4)称取一定质量的PbI2固体,用蒸馏水配制成室温时的饱和溶液,准确移取25.00mL PbI2饱和溶液分次加入阳离子交换树脂RH中,发生:2RH(s)+Pb2+(aq)═R2Pb(s)+2H+(aq),用锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液合并到锥形瓶中.加入2~3滴酚酞溶液,用0.002500mol•L-1NaOH溶液滴定,到滴定终点时用去氢氧化钠标准溶液20.00mL.则室温时PbI2 的Ksp为4.000×10-9.
(5)探究浓度对碘化铅沉淀溶解平衡的影响.
该化学小组根据所提供试剂设计两个实验,来说明浓度对沉淀溶解平衡的影响.
提供试剂:NaI饱和溶液、NaCl饱和溶液、FeCl3 饱和溶液、PbI2饱和溶液、PbI2悬浊液.
信息提示:Pb2+和Cl-能形成较稳定的PbCl42-络离子.
请填写下表的空白处:
| 实验内容 | 实验方法 | 实验现象及原因分析 |
| ①碘离子浓度增大对平衡的影响 | 取PbI2饱和溶液少量于一支试管中,再滴入几滴NaI饱和溶液 | 现象:溶液中c(I-)增大,使Q大于了PbI2的Ksp |
| ②铅离子浓度减小对平衡的影响 | 取PbI2悬浊液少量于一支试管中,再加入少量NaCl饱和溶液 | 现象:黄色浑浊消失 原因:形成PbCl42-,导致溶液中c(Pb2+)减小,使Qc小于PbI2的Ksp |
| ③铅离子和碘离子浓度都减小对平衡的影响 | 在PbI2悬浊液中滴入几滴FeCl3饱和溶液 | 现象:黄色浑浊消失 写出反应的离子方程式:PbI2+2Fe3++4Cl-=PbCl42-+2Fe2++I2 |
| A. | 将FeCl2溶液在空气中加热蒸干并灼烧,最终得到黑色FeO固体 | |
| B. | 同浓度的氨水,NH4Cl、(NH4)2SO4溶液中水电离出氢离子浓度相同 | |
| C. | 一定浓度的氨水和盐酸混合存在关系:c(NH4+)+c(H+)=c(OH-)+c(Cl-) | |
| D. | 室温下,0.1mol/L的HA溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=1010,则NaA溶液显酸性 |
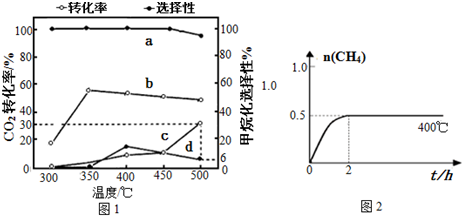
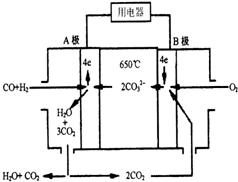 现有一个碳酸盐燃料电池,以一定比例的Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,直接以水煤气(CO、H2的体积比为1:1)为燃料,其工作原理如图所示.
现有一个碳酸盐燃料电池,以一定比例的Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,直接以水煤气(CO、H2的体积比为1:1)为燃料,其工作原理如图所示.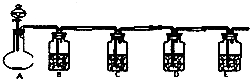 设计一实验将只含有Na2SO4、Na2SO3、Na2CO3的白色固体中的三种成分检验出来.取一定量的白色固体与烧瓶A中,通过分液漏斗加入液体a,如图所示:
设计一实验将只含有Na2SO4、Na2SO3、Na2CO3的白色固体中的三种成分检验出来.取一定量的白色固体与烧瓶A中,通过分液漏斗加入液体a,如图所示: