题目内容
7.某有机化合物A经李比希法测得其中含碳为72.0%、含氢为 6.67%,其余为氧.现用下列方法测定该有机化合物的相对分子质量和分子结构.方法一:用质谱法分析得知A的相对分子质量为150.
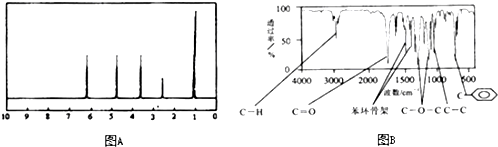
方法二:A的核磁共振氢谱有5个峰,其面积之比为1:2:2:2:3,如图A.
方法三:利用红外光谱仪测得A分子的红外光谱如图B.
请回答下列问题:
(1)A的分子式为C9H10O2.
(2)A的结构简式可能为(写出三种)C6H5COOCH2CH3、C6H5CH2COOCH3、C6H5OOCCH2CH3.
(3)A的芳香类同分异构体有多种,请写出分子中不含甲基的芳香酸的结构简式C6H5CH2CH2COOH.
分析 有机物A中C原子个数N(C)=$\frac{72%×150}{12}$=9,有机物A中H原子个数N(H)=$\frac{6.67%×150}{1}$=10,有机物A中O原子个数N(O)=$\frac{(1-72%-6.67%)×150}{16}$=2,
所以有机物A的分子式为C9H10O2,由红外光谱可知分子含有酯基,A的核磁共振氢谱有5个峰,其面积之比为1:2:2:2:3,则苯环可含有1个支链,如为不含甲基的芳香酸,可为苯丙酸,以此解答该题.
解答 解:(1)有机物A中C原子个数N(C)=$\frac{72%×150}{12}$=9,有机物A中H原子个数N(H)=$\frac{6.67%×150}{1}$=10,有机物A中O原子个数N(O)=$\frac{(1-72%-6.67%)×150}{16}$=2,
所以有机物A的分子式为C9H10O2,
故答案为:C9H10O2;
(2)由A分子的红外光谱知,含有C6H5C-基团,由苯环上只有一个取代基可知,苯环上的氢有三种,H原子个数分别为1个、2个、2个.由A的核磁共振氢谱可知,除苯环外,还有两种氢,且两种氢的个数分别为2个、3个,由A分子的红外光谱可知,A分子结构有碳碳单键及C-H、C=O、C-O等基团,所以符合条件的有机物A结构简式为C6H5COOCH2CH3、C6H5CH2COOCH3、C6H5OOCCH2CH3,
故答案为:C6H5COOCH2CH3、C6H5CH2COOCH3、C6H5OOCCH2CH3;
(3)如为不含甲基的芳香酸,可为苯丙酸,结构简式为C6H5CH2CH2COOH,
故答案为:C6H5CH2CH2COOH.
点评 本题考查有机物的推断,为高频考点和常见题型,侧重于学生的分析能力和计算能力的考查,注意把握有机物的结构和性质的关系,把握提给信息,难度不大,答题时注意审题.

| A. | 加人少量KOH固体 | B. | 滴人少量盐酸 | ||
| C. | 加入少量硫化钠固体 | D. | 加人少量纯水 |
| A. | 标准状况下,1L C2H5OH完全燃烧后生成的CO2分子个数约为NA/11.2 | |
| B. | 18g 50%的遮糖水溶液中原子总数约为1.6 NA | |
| C. | 0℃、101KPa下,4.48LNH3中共用电子对数为0.6NA | |
| D. | 将lmol Cl2通入水中,HClO、Cl-、ClO- 粒子数之和为2NA |
| A. | 1 mol氢为2 g | B. | H2O的摩尔质量为18 g | ||
| C. | 44 g CO2的体积为22.4 L | D. | 9.8 g H2SO4含0.1NA个H2SO4分子 |
| A. | 标准状况下,5.6 L CO2与足量Na2O2反应转移的电子数为0.5 NA | |
| B. | 足量Cu和含4 mol HNO3的浓硝酸反应可生成2 NA个NO2分子 | |
| C. | 2.0 g H218O与D2O的混合物中所含中子数为NA | |
| D. | 在pH=13 的NaOH 溶液中,OH-的数目为0.1 NA |
| A. | 酸性强弱:HClO4>H3PO4>H2SO4 | B. | 原子半径大小:Na>P>N | ||
| C. | 碱性强弱:NaOH>Mg(OH)2>Al(OH)3 | D. | 金属性强弱:K>Na>Li |
| A. | Fe+CuSO4═FeSO4+Cu 氧化性Fe>Cu | |
| B. | Cl2+2KI═2KCl+I2氧化性Cl2>I2 | |
| C. | H2+CuO═Cu+H2O CuO是还原剂 | |
| D. | CaCO3+H2O+CO2═Ca(HCO3)2 是氧化还原反应 |
| A. | Na2CO3 | B. | NaOH | C. | Na2SiO3 | D. | CaCl2 |
| 元素 | 相关信息 |
| X | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
| Y | 地壳中含量最高的元素 |
| Z | 存在质量数为23,中子数为11的核素 |
| W | 生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质 |
| R | 有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
 ; X、Y、Z三种元素的原子半径从大到小的顺序是Mg>N>O (用元素符号表示).
; X、Y、Z三种元素的原子半径从大到小的顺序是Mg>N>O (用元素符号表示).(2)X与氢两元素按原子数目比1:3构成分子A,A的电子式为
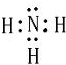 ;化合物ZY中存在的化学键类型为离子键 (填“离子键”或“共价键”).
;化合物ZY中存在的化学键类型为离子键 (填“离子键”或“共价键”).(3)砷(As)是人体必需的微量元素,与X同一主族,As原子比X原子多两个电子层,则砷的气态氢化物的稳定性比X的气态氢化物的稳定性若(填“强”或“弱”).
(4)检验溶液中R3+常用的试剂是KSCN溶液,可以观察到的现象是溶液呈红色.