题目内容
1.下列实验方法或操作正确的是( )| A. | 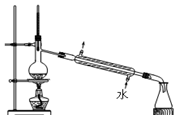 制蒸馏水 | B. | 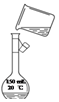 转移溶液 | ||
| C. | 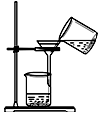 过滤 | D. | 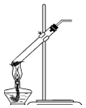 分解NaHCO3固体 |
分析 A.蒸馏法可制备蒸馏水,温度计测定馏分的温度,冷水下进上出;
B.转移液体需要引流;
C.过滤需要引流;
D.碳酸氢钠分解生成碳酸钠、水、二氧化碳.
解答 解:A.蒸馏法可制备蒸馏水,温度计测定馏分的温度,冷水下进上出,图中蒸馏装置合理,故A正确;
B.转移液体需要引流,图中缺少玻璃棒,故B错误;
C.过滤需要引流,图中缺少玻璃棒,故C错误;
D.碳酸氢钠分解生成碳酸钠、水、二氧化碳,为防止生成的水倒流,试管口应略向下倾斜,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握实验装置的作用、混合物分离提纯、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
11.设NA 为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,1.12LCCl4含有C-Cl键数目为0.2NA | |
| B. | 标准状况下,2.24L氯气中含有的Cl数目一定为0.2NA | |
| C. | 常温常压下,4.4gCO2与N2O混合气体中含有的原子总数为0.3NA | |
| D. | 56 g的Fe与足量的稀盐酸完全反应转移电子数为3NA |
16.能源是人类生存和发展的重要支柱,研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义,已知下列热化学方程式
①H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-242kJ/mol;
②2H2(g)+O2(g)=2H2O(l)△H=-572kJ/mol;
③C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ/moL;
④C(s)+O2(g)=CO2(g)△H=-393.5kJ/moL;
⑤CO2(g)+2H2O(g)=CH4(g)+2O2(g)△H=+802kJ/moL
回答下列问题
(1)写出能表示H2燃烧热的热化学方程式:H2(g)+0.5 O2(g)=H2O(l)△H=-286kJ/mol
(2)计算C(s)+H2O(g)?H2(g)+CO(g)△H=+131.5 kJ/moL;
(3)估算出C=O键能为800kJ/moL.
(4)CH4的燃烧热△H=-890 kJ/moL.
(5)25℃、101kPa下,某燃具中CH4的燃烧效率是90%(注:相当于10%的CH4未燃烧),水壶的热量利用率是70%,则用此燃具和水壶,烧开1L水所需要的CH4的物质的量为0.56mol[保留到小数点后2位;已知:c (H2O)=4.2J/(g•℃)].
①H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-242kJ/mol;
②2H2(g)+O2(g)=2H2O(l)△H=-572kJ/mol;
③C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ/moL;
④C(s)+O2(g)=CO2(g)△H=-393.5kJ/moL;
⑤CO2(g)+2H2O(g)=CH4(g)+2O2(g)△H=+802kJ/moL
| 化学键 | O=O | C-C | H-H | O-O | C-O | O-H | C-H |
| 键能kJ/mol | 497 | 348 | 436 | 142 | 351 | 463 | 414 |
(1)写出能表示H2燃烧热的热化学方程式:H2(g)+0.5 O2(g)=H2O(l)△H=-286kJ/mol
(2)计算C(s)+H2O(g)?H2(g)+CO(g)△H=+131.5 kJ/moL;
(3)估算出C=O键能为800kJ/moL.
(4)CH4的燃烧热△H=-890 kJ/moL.
(5)25℃、101kPa下,某燃具中CH4的燃烧效率是90%(注:相当于10%的CH4未燃烧),水壶的热量利用率是70%,则用此燃具和水壶,烧开1L水所需要的CH4的物质的量为0.56mol[保留到小数点后2位;已知:c (H2O)=4.2J/(g•℃)].