题目内容
外围电子排布为4d105s1的元素在周期表中应位于( )
| A、第4周期ⅠB族 |
| B、第5周期ⅠB族 |
| C、第5周期ⅡB族 |
| D、第5周期ⅢB族 |
考点:原子核外电子排布
专题:
分析:外围电子排布为4d105s1的元素,根据5s可以判断该元素位于第五周期,再根据外围电子总数为11可知该元素位于周期表从左向右第11列,据此判断该元素的族序数.
解答:
解:根据外围电子排布4d105s1可知,该元素最外层为5s,则位于周期表中第5周期,
该元素外围电子总数为11,则该元素位于周期表从左向右第11列,其中ⅤⅢB为8、9、10纵行,则该元素位于周期表ⅠB族,
故选B.
该元素外围电子总数为11,则该元素位于周期表从左向右第11列,其中ⅤⅢB为8、9、10纵行,则该元素位于周期表ⅠB族,
故选B.
点评:本题考查了原子核外电子排布及元素周期表结构,题目难度不大,熟练掌握元素周期表结构为解答关键,注意明确原子核外电子排布式的书写方法,试题侧重基础知识的考查,培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目
下列图示装置的实验中,操作正确的是( )


| A、图1配制250 mL 0.10 mol?L-1盐酸 |
| B、图2稀释浓硫酸 |
| C、图3称量氯化钠固体 |
| D、图4检验铁粉与水蒸气反应产生的氢气 |
T℃时在2L容积不变的密闭容器中使X(g)与Y(g)发生反应生成Z(g).反应过程中X、Y、Z的浓度变化如图1所示.则下列结论正确的是( )
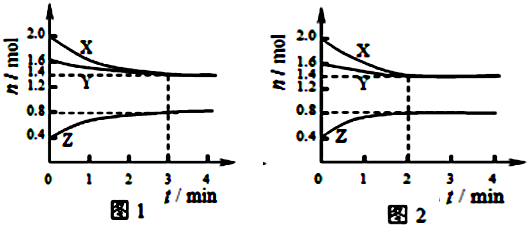

| A、容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g) |
| B、反应进行前3min内,用X表示的反应速率v(X)=0.1mol/(L?min) |
| C、若改变反应条件,使反应进程如图2所示,则改变的条件是增大压强 |
| D、如图1所示,该反应达到化学平衡时,X的转化率为70% |
有关晶体的叙述中,错误的是( )
| A、区分晶体和非晶体最可靠的科学方法是对固体进行X-射线衍射实验 |
| B、晶体与非晶体的本质区别在于是否具有规则的几何外形 |
| C、分子晶体熔化时,不破坏共价键;原子晶体熔化时,破坏共价键 |
| D、在金属铜的晶体中,由于存在自由电子,因此铜能导电 |
下列各物质中,按熔点由高到低的顺序排列正确的是( )
| A、CH4>SiH4>GeH4>SnH4 |
| B、KCl>NaCl>NaF>LiF |
| C、Rb>K>Na>Li |
| D、金刚石>氯化钠>钠>干冰 |
下列各组物质不属于同分异构体的是( )
| A、苯和环己烷 |
| B、邻氯甲苯和对氯甲苯 |
| C、丙醛(CH3CH2CHO)和丙烯醇(CH2=CHCH2OH) |
| D、苯甲醇和对甲基苯酚 |
下列说法错误的是( )
| A、所有金属元素都可以用焰色反应来确定其存在 |
| B、三位美国科学家因给复杂化学体系设计多尺度模型面共享了2013年诺贝尔化学奖 |
| C、已知PM2.5是指大气中直径≤2.5微米的颗粒物,对人体健康危害很大 |
| D、借助仪器来分析化学物质的组成是常用的手段,原子吸收光谱常用来确定物质中含有哪些金属元素 |
关于如图所示装置的下列叙述,正确的是( )
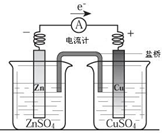

| A、电流方向是从锌片经导线流向铜片 |
| B、锌是阳极,锌片上有大量气泡产生 |
| C、铜离子在铜片表面被氧化,质量逐渐增大 |
| D、盐桥作用主要是离子通道和保持溶液电中性 |
