题目内容
4. 已知A、B、C、D、E、F是周期表前四周期的元素,原子序数依次增大.A的基态原子2p能级有2个单电子;C占整个地壳质量的48.6%,是地壳中含量最多的元素;E的单质常温常压下为黄绿色气体,化学性质十分活泼,具有毒性;F位于ds区,最外能层有单电子,是唯一的能大量天然产出的金属;D与F不同周期,但最外能层电子数相等.
已知A、B、C、D、E、F是周期表前四周期的元素,原子序数依次增大.A的基态原子2p能级有2个单电子;C占整个地壳质量的48.6%,是地壳中含量最多的元素;E的单质常温常压下为黄绿色气体,化学性质十分活泼,具有毒性;F位于ds区,最外能层有单电子,是唯一的能大量天然产出的金属;D与F不同周期,但最外能层电子数相等.(1)写出基态F原子的价电子排布式3d104s1
(2)A、B、C三种元素第一电离能由大到小顺序为N>O>C (用元素符号表示)
(3)A、C两元素形成的化合物AC2的分子空间构型直线型,AC2中心原子的杂化方式sp,与 AC2互为等电子体的粒子的化学式N2O,NO2+ (分子和离子各写一种).
(4)D、E形成的一种离子化合物,在如图晶胞结构图中黑球表示E的位置,白球表示D的位置,已知该晶胞的边长为n cm,阿伏加德罗常数为NA,求晶胞的密度ρ=$\frac{234}{{n}^{3}{N}_{A}}$ g/cm3(用含a、NA的计算式表示).
分析 A、B、C、D、E、F是周期表前四周期的元素,原子序数依次增大.A的基态原子2p能级有2个单电子,原子核外电子排布式为1s22s22p2,故A为碳元素;C占整个地壳质量的48.6%,是地壳中含量最多的元素,则C为O元素;E的单质常温常压下为黄绿色气体,化学性质十分活泼,具有毒性,则E为Cl;F位于ds区,最外能层有单电子,是唯一的能大量天然产出的金属,F为Cu;D与F不同周期,但最外能层电子数相等,D的原子序数大于氧、小于Cl,可知D为Na,据此进行解答.
解答 解:(1)F为Cu元素,为29号元素,原子核外电子数为29,基态原子核外电子排布式为:1s22s22p63s23p63d104s1,则其价电子排布式为:3d104s1;
故答案为:3d104s1;
(2)同一周期随着原子序数的递增,元素的第一电离能总体呈现增大趋势,N原子原子2p轨道为半满稳定状态,能量较低,第一电离能大于氧元素的,所以第一电离能大小为:N>O>C,
故答案为:N>O>C;
(3)AC2为CO2,二氧化碳分子中含有两个碳氧双键,为直线型结构;二氧化碳分子中,碳原子形成2个σ键,没有孤对电子,则C原子的杂化轨道类型为sp,
A、C两元素形成的化合物CO2的分子空间构型为直线形,与CO2互为等电子体的粒子的化学式有N2O、NO2+ 等,
故答案为:直线型;sp;N2O、NO2+;
(4)E为Cl、D为Na,晶胞中氯离子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,钠离子数目为1+12×$\frac{1}{4}$=4,则晶胞质量为4×$\frac{58.5}{{N}_{A}}$g,晶胞的边长为n cm,
则晶胞的密度ρ=$\frac{\frac{58.5}{{N}_{A}}×4g}{({ncm)}^{3}}$=$\frac{234}{{n}^{3}{N}_{A}}$g/cm3,
故答案为:$\frac{234}{{n}^{3}{N}_{A}}$g/cm3.
点评 本题考查较为综合,涉及核外电子排布、电离能、空间构型、等电子体、晶胞计算等知识,题目难度中等,掌握均摊法进行晶胞有关计算,注意同周期第一电离能异常情况,试题培养了学生的分析能力及综合应用能力.

 ),同时利用此装置的电能在铁上镀铜,下列说法错误的是( )
),同时利用此装置的电能在铁上镀铜,下列说法错误的是( )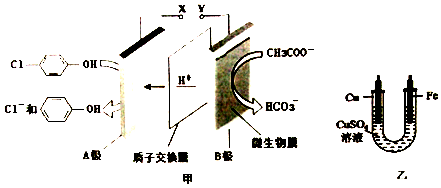
| A. | 铁电极应与Y相连接 | |
| B. | 反应过程中甲中右边区域溶液pH逐渐升高 | |
| C. | A极的电极反应式为 +2e-+H+=Cl-+ +2e-+H+=Cl-+ | |
| D. | 当外电路中有0.2 mole-转移时,A极区增加的H+的个数为0.1NA |
| A. | -167℃ | B. | -87℃ | C. | -35℃ | D. | 50℃ |
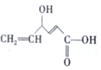 ,下列关于X的说法正确的是( )
,下列关于X的说法正确的是( )| A. | X中有4种官能团 | |
| B. | X的分子式为C6H5O3 | |
| C. | X可发生氧化、取代、加成反应 | |
| D. | 1molX与足量钠反应可生成11.2L气体(标准状况) |
| A. | 两溶液中存在的微粒种类:a>b | B. | c(NH4+):a>b | ||
| C. | c(OH-):a<b | D. | 水电离出的c(H+):a<b |
 将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4 (s)?2NH3(g)+CO2 (g).该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是( )
将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4 (s)?2NH3(g)+CO2 (g).该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是( )| A. | C点对应状态的平衡常数K(C)=10-3.638 | |
| B. | 该反应的△H>0 | |
| C. | NH3的体积分数不变时,该反应一定达到平衡状态 | |
| D. | 30℃时,B点对应状态的v(正)<v(逆) |

| A. | a电极为正极 | |
| B. | H+由右室通过质子交换膜进入左室 | |
| C. | a电极反应式为:C6H5OH-28e-+11H2O═6CO2↑+28H+ | |
| D. | 当b电极上产生lmol N2时,溶液中将有l0mol e-通过 |
| A. | 原子半径:Br>Ga>Cl>Al | |
| B. | 碱性:Ga(OH)3>Al(OH)3 酸性:HClO4>HBrO4 | |
| C. | 7935Br与8135Br得电子能力不同 | |
| D. | 与镓同周期且相邻的主族元素,其原子序数为30或32 |
| A. | v(H2)=0.05mol/(L•min) | B. | v(N2)=0.03mol/(L•min) | ||
| C. | v(NH3)=0.17g/(L•min) | D. | v(NH3)=0.02mol/(L•min) |