题目内容
9.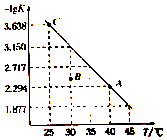 将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4 (s)?2NH3(g)+CO2 (g).该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是( )
将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4 (s)?2NH3(g)+CO2 (g).该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是( )| A. | C点对应状态的平衡常数K(C)=10-3.638 | |
| B. | 该反应的△H>0 | |
| C. | NH3的体积分数不变时,该反应一定达到平衡状态 | |
| D. | 30℃时,B点对应状态的v(正)<v(逆) |
分析 由图象可知,升高温度,平衡常数的负对数减小,说明升高温度K增大,平衡正向移动,则正反应为吸热反应,由化学方程式可知反应得到NH3、CO2的物质的量之比为2:1,反应开始后氨气体积分数始终不变,结合浓度商与平衡常数的关系判断反应的方向,以此解答该题.
解答 解:A.C点-lgK=3.638,则平衡常数K=10-3.638,故A正确;
B.-lgK越大,则平衡常数K越小,由图可知,随温度升高,平衡常数增大,则升高温度平衡正向移动,正反应为吸热反应,故该反应的△H>0,故B正确;
C.反应得到NH3、CO2的物质的量之比为2:1,反应开始后氨气体积分数始终不变,NH3的体积分数不变不能说明该反应达到平衡状态,故C错误;
D.B点浓度商大于平衡常数,反应向逆反应进行,则B点对应状态的υ(正)<υ(逆),故D正确.
故选C.
点评 本题考查化学平衡常数及其应用、平衡状态判断等,为高考常见题型,侧重考查学生的分析能力,题目C选项为易错点,学生容易根据平衡时各组分含量不变进行判断,难度中等.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
19.化学与生产、生活密切相关,下列与化学有关的说法正确的是( )
| A. | 生理盐水和A1(OH)3胶体的本质区别是能否产生丁达尔效应 | |
| B. | 纤维素和聚氯乙烯均为可降解的高分子化合物 | |
| C. | 水晶项链和玻璃杯均属于硅酸盐产品 | |
| D. | 耐蚀合金的防腐原理与电化学无关 |
20.下列物质的工业生产原理不涉及氧化还原反应的是( )
| A. | 氨气 | B. | 纯碱 | C. | 硫酸 | D. | 烧碱 |
17.“同位素示踪法,可帮助人们认识化学反应的机理.下列反应中同位素示踪表示正确的是( )
| A. | 2Na2O2+2H218O═4NaOH+18O2↑ | |
| B. | K37ClO3+6HCl═K37Cl+3Cl2↑+3H2O | |
| C. | NH4Cl+2H2O?NH3•2H2O+HCl | |
| D. | CH3COOH+CH3CH218OH$?_{△}^{浓硫酸}$CH3CO18OCH2CH3+H2O |
14.化学与科学、技术、社会、环境密切相关.下列说法不正确的是( )
| A. | 为加快漂白精的漂白速率,使用时可滴加几滴醋酸 | |
| B. | 在食品袋中放人盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| C. | 用含橙色酸性重铬酸钾的仪器检验酒驾,利用了乙醇的挥发性和还原性 | |
| D. | 光太阳能电池先将光能转化为化学能,然后再将化学能转化为电能 |
1.化学与生产、生活、社会密切相关.下列说法中正确的是( )
| A. | 过程的自发性只能用于判断过程的方向性,不能确定过程是否一定会发生和过程发生的速率 | |
| B. | 李白诗句“日照香炉生紫烟,遥看瀑布挂前川”,“紫烟”指“香炉”中碘升华的现象 | |
| C. | 用纳米铁粉的吸附性去除污水中的Cu2+、Hg2+等重金属离子 | |
| D. | 用高锰酸钾溶液、酒精、双氧水的氢氧化性进行杀菌消毒 |
18.下列两组反应,反应类型相同的是( )
| 组别 | Ⅰ | Ⅱ |
| A | 常温下,乙烯和氯气混合 | 乙烷和氯气混合光照 |
| B | 乙酸、乙醇、浓硫酸混合,加热 | 在FeBr3催化下,苯与液溴反应 |
| C | 苯和浓硫酸、浓硝酸混合,加热到50~60℃ | 乙烯在一定条件下与水反应 |
| D | 由乙烯制取聚乙烯 | 蔗糖与稀硫酸混合,加热 |
| A. | A | B. | B | C. | C | D. | D |
18.下列图象不符合事实是( )
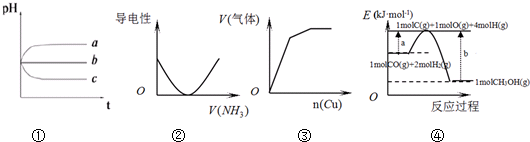

| A. | 图①:pH相同的H2S溶液(a)、稀H2SO4溶液(b)、H2SO3溶液(c)露置于空气中一段时间后,溶液的pH随时间的变化情况 | |
| B. | 图②:表示向乙酸溶液中通入NH3过程中溶液导电性的变化 | |
| C. | 图③:将铜粉加入到一定量浓硝酸中产生的气体与加入铜量的变化情况 | |
| D. | 图④:合成甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(g)△H=a-b kJ•mol-1 |
 已知A、B、C、D、E、F是周期表前四周期的元素,原子序数依次增大.A的基态原子2p能级有2个单电子;C占整个地壳质量的48.6%,是地壳中含量最多的元素;E的单质常温常压下为黄绿色气体,化学性质十分活泼,具有毒性;F位于ds区,最外能层有单电子,是唯一的能大量天然产出的金属;D与F不同周期,但最外能层电子数相等.
已知A、B、C、D、E、F是周期表前四周期的元素,原子序数依次增大.A的基态原子2p能级有2个单电子;C占整个地壳质量的48.6%,是地壳中含量最多的元素;E的单质常温常压下为黄绿色气体,化学性质十分活泼,具有毒性;F位于ds区,最外能层有单电子,是唯一的能大量天然产出的金属;D与F不同周期,但最外能层电子数相等.