题目内容
短周期元素A、B、C、D,其有关性质或结构信息如表所示.
(1)B位于元素周期表中第 周期第 族,A元素的价电子排布式 ,元素B和元素C相比,电负性较小的是 (写元素名称).化合物BC2晶体与B的单质晶体属 (填同一类型或不同类型),理由 .
(2)C和D的气态氢化物中,较稳定的是 (写化学式),B的原子.C的原子和氢原子形成一种含有氢键且相对分子质量最小的有机物名称 .
(3)C与D可以组成多种形式的化合物.其中D2C5能够水反应生成物质X.写出物质X的稀溶液与过量的Fe反应的现象 ,离子方程式: .
(4)A的最高价氧化物为无色液体,9.15g该物质与足量的水混合,得到一种稀溶液,并放出QKJ热量,该反应的热化学反应方程式为 .
| 元素 | A | B | C | D |
| 有关性质或结果信息 | 能形成+7价的化合物 | 基态原子核外s能级上的电子数是p能级上电子数的2倍 | 该元素形成的单质通常有两种同位素异形体,其中一种单质分布在高空,起着阻止紫外辐射的作用 | 通常情况下能形成短周期中最稳定的双原子分子 |
(2)C和D的气态氢化物中,较稳定的是
(3)C与D可以组成多种形式的化合物.其中D2C5能够水反应生成物质X.写出物质X的稀溶液与过量的Fe反应的现象
(4)A的最高价氧化物为无色液体,9.15g该物质与足量的水混合,得到一种稀溶液,并放出QKJ热量,该反应的热化学反应方程式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:短周期元素A、B、C、D,A能形成+7价的化合物,则A为Cl;B基态原子核外s能级上的电子数是p能级上电子数的2倍,原子核外电子排布为1s22s22p2,则B为碳元素;C元素形成的单质通常有两种同位素异形体,其中一种单质分布在高空,起着阻止紫外辐射的作用,则C为O元素;通常情况下D能形成短周期中最稳定的双原子分子,则D为N元素,据此解答.
解答:
解:短周期元素A、B、C、D,A能形成+7价的化合物,则A为Cl;B基态原子核外s能级上的电子数是p能级上电子数的2倍,原子核外电子排布为1s22s22p2,则B为碳元素;C元素形成的单质通常有两种同位素异形体,其中一种单质分布在高空,起着阻止紫外辐射的作用,则C为O元素;通常情况下D能形成短周期中最稳定的双原子分子,则D为N元素,
(1)B为碳元素,位于元素周期表中第二周期第ⅣA族,A为Cl元素,价电子排布式为3s23p5,同周期随原子序数增大电负性增大,故电负性O>C,化合物CO2晶体属于分子晶体,与碳的单质中金刚石属于原子晶体,二者晶体类型不同(或同一类型、都是分子晶体),
故答案为:二、ⅣA;3s23p5;碳;不同类型、前者属于分子晶体后者属于原子晶体(或同一类型、都是分子晶体);
(2)非金属性O>N,故氢化物稳定性H2O>NH3,C原子、O原子和氢原子形成一种含有氢键且相对分子质量最小的有机物为CH3OH,名称为甲醇,
故答案为:H2O;甲醇;
(3)N2O5与水反应生成X为HNO3,稀硝酸溶液与过量的Fe反应生成硝酸亚铁、NO与水,反应的现象为:固体溶解,溶液变为浅绿色,有气体生成,反应离子方程式为:3Fe+8H++2NO3-═3Fe 2++2NO↑+4H2O,
故答案为:固体溶解,溶液变为浅绿色,有气体生成;3Fe+8H++2NO3-═3Fe 2++2NO↑+4H2O;
(4)9.15gCl2O7的物质的量=
=0.05mol,0.05molCl2O7与一定量水混合得到HClO4溶液时,放出QkJ的热量,则1molCl2O7与一定量水混合得到HClO4溶液时,放出的热量=QkJ×
=20QkJ,所以热化学方程式为:Cl2O7(1)+H2O(1)=2HClO4(aq);△H=-20QkJ?mol-1,
故答案为:Cl2O7(1)+H2O(1)=2HClO4(aq);△H=-20QkJ?mol-1.
(1)B为碳元素,位于元素周期表中第二周期第ⅣA族,A为Cl元素,价电子排布式为3s23p5,同周期随原子序数增大电负性增大,故电负性O>C,化合物CO2晶体属于分子晶体,与碳的单质中金刚石属于原子晶体,二者晶体类型不同(或同一类型、都是分子晶体),
故答案为:二、ⅣA;3s23p5;碳;不同类型、前者属于分子晶体后者属于原子晶体(或同一类型、都是分子晶体);
(2)非金属性O>N,故氢化物稳定性H2O>NH3,C原子、O原子和氢原子形成一种含有氢键且相对分子质量最小的有机物为CH3OH,名称为甲醇,
故答案为:H2O;甲醇;
(3)N2O5与水反应生成X为HNO3,稀硝酸溶液与过量的Fe反应生成硝酸亚铁、NO与水,反应的现象为:固体溶解,溶液变为浅绿色,有气体生成,反应离子方程式为:3Fe+8H++2NO3-═3Fe 2++2NO↑+4H2O,
故答案为:固体溶解,溶液变为浅绿色,有气体生成;3Fe+8H++2NO3-═3Fe 2++2NO↑+4H2O;
(4)9.15gCl2O7的物质的量=
| 9.15g |
| 183g/mol |
| 1mol |
| 0.05mol |
故答案为:Cl2O7(1)+H2O(1)=2HClO4(aq);△H=-20QkJ?mol-1.
点评:本题考查结构性质位置关系应用,推断元素是解题关键,题目考察的知识面较广,难度不大,要求学生熟练掌握基础知识,学以致用.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
进行一氯取代反应后,只能生成三种沸点不同产物( )
A、 |
B、 |
C、 |
D、 |
下列各组气体通常情况下能大量共存,并且既能用浓硫酸干燥,又能用碱石灰干燥的是( )
| A、SO2、O2、HBr |
| B、H2、CH4、O2 |
| C、NH3、CO2、HCl |
| D、NH3、O2、N2 |
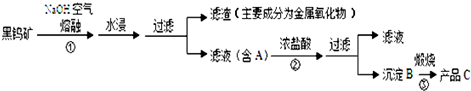
 除一种元素外,其余由元素周期表中前20号元素组成的物质A、B、C、D、E,它们间的反应关系如图:
除一种元素外,其余由元素周期表中前20号元素组成的物质A、B、C、D、E,它们间的反应关系如图: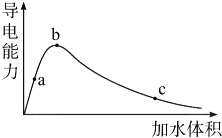 Ⅰ.醋酸是我们很熟悉的一种有机物.
Ⅰ.醋酸是我们很熟悉的一种有机物.