题目内容
钨(74W)是我国丰产元素,是熔点最高的金属,广泛用于拉制灯泡的灯丝,在自然界主要以钨(+6价)酸盐的形式存在.黑钨矿是冶炼钨的主要矿石之一.它的主要成分是铁和锰的钨酸盐(FeWO4和MnWO4).
黑钨矿传统冶炼工艺的第一阶段是碱熔法(工业流程如图所示):
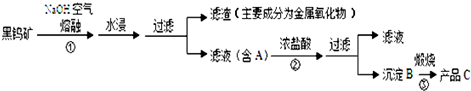
已知:①钨酸(H2WO4)酸性很弱,难溶于水.②在冶炼过程中钨元素的化合价保持不变.
(1)74W在周期表的位置是第 周期.
(2)操作①中MnWO4转化为MnO2的化学方程式 .
(3)实验室检验滤渣中含有Fe2O3的方法是 .
(4)上述流程中B、C都是钨的化合物,则B为 ,B→C的反应类型是 .
(5)钨冶炼工艺的第二阶段是用氢气、铝等还原剂把产品C还原为金属钨.对钨的纯度要求不高时,可用铝作还原剂.写出用铝还原产品C制取金属钨的化学方程式 ;实验室引发该反应的操作方法是 .
(6)常温下,黑钨矿中FeWO4和MnWO4的溶度积常数分别为:Ksp(FeWO4)=2.5×10-12;Ksp(MnWO4)=7.5×10-16;欲将体积为1L含MnWO4物质的量为0.6mol悬浊液全部转化为FeWO4悬浊液,理论上可往MnWO4悬浊液加入等体积一定浓度的FeCl2溶液完成上述转化;请计算所加入FeCl2溶液浓度为 mol/L,所以实际生产过程 (填“能”或“不能”)通过加入FeCl2溶液的方法实现上述转化.(注:混合后溶液体积变化可忽略.)
黑钨矿传统冶炼工艺的第一阶段是碱熔法(工业流程如图所示):

已知:①钨酸(H2WO4)酸性很弱,难溶于水.②在冶炼过程中钨元素的化合价保持不变.
(1)74W在周期表的位置是第
(2)操作①中MnWO4转化为MnO2的化学方程式
(3)实验室检验滤渣中含有Fe2O3的方法是
(4)上述流程中B、C都是钨的化合物,则B为
(5)钨冶炼工艺的第二阶段是用氢气、铝等还原剂把产品C还原为金属钨.对钨的纯度要求不高时,可用铝作还原剂.写出用铝还原产品C制取金属钨的化学方程式
(6)常温下,黑钨矿中FeWO4和MnWO4的溶度积常数分别为:Ksp(FeWO4)=2.5×10-12;Ksp(MnWO4)=7.5×10-16;欲将体积为1L含MnWO4物质的量为0.6mol悬浊液全部转化为FeWO4悬浊液,理论上可往MnWO4悬浊液加入等体积一定浓度的FeCl2溶液完成上述转化;请计算所加入FeCl2溶液浓度为
考点:物质分离和提纯的方法和基本操作综合应用,难溶电解质的溶解平衡及沉淀转化的本质,制备实验方案的设计
专题:实验设计题,电离平衡与溶液的pH专题,元素及其化合物
分析:(1)根据核外电子数及电子排布分析;
(2)根据氧化铁和氧化锰不溶于水,钨酸钠易溶于水判断A为钨酸钠,则MnWO4与NaOH反应生成二氧化锰和钨酸钠;
(3)把氧化铁转化为三价铁离子的溶液,再用硫氰化钾检验;
(4)Na2WO4与浓盐酸反应生成氯化钠和H2WO4;H2WO4易分解为氧化钨和水;
(5)高温条件下,铝与氧化钨反应生成单质钨和氧化铝,根据原子守恒书写;在铝热剂上加少量KClO3,插上镁条并将其点燃;
(6)根据Ksp(FeWO4)=c(Fe2+)?c(WO42-)=2.5×10-12,结合亚铁离子的浓度计算即可.
(2)根据氧化铁和氧化锰不溶于水,钨酸钠易溶于水判断A为钨酸钠,则MnWO4与NaOH反应生成二氧化锰和钨酸钠;
(3)把氧化铁转化为三价铁离子的溶液,再用硫氰化钾检验;
(4)Na2WO4与浓盐酸反应生成氯化钠和H2WO4;H2WO4易分解为氧化钨和水;
(5)高温条件下,铝与氧化钨反应生成单质钨和氧化铝,根据原子守恒书写;在铝热剂上加少量KClO3,插上镁条并将其点燃;
(6)根据Ksp(FeWO4)=c(Fe2+)?c(WO42-)=2.5×10-12,结合亚铁离子的浓度计算即可.
解答:
解:(1)74W的质子数可知电子数为74,核外各电子层电子数为2、8、18、32、14、2,电子层数等于周期序数,所以在周期表的位置是第六周期,
故答案为:六;
(2)氧化铁和氧化锰不溶于水,钨酸钠易溶于水判断A为钨酸钠,则MnWO4与NaOH反应生成二氧化锰和钨酸钠,反应中锰元素化合价升高作还原剂,氧气作氧化剂,其反应方程式为:2MnWO4+4NaOH+O2
2Na2WO4+2MnO2+2H2O,
故答案为:2MnWO4+4NaOH+O2
2Na2WO4+2MnO2+2H2O;
(3)实验室检验滤渣中含有Fe2O3的方法是:把氧化铁转化为三价铁离子的溶液,再用硫氰化钾检验,即取少量滤渣于试管中,加适量稀盐酸溶解.取少量上层清液,滴加硫氰化钾溶液,若溶液变红即含有Fe2O3;
故答案为:取少量滤渣于试管中,加适量稀盐酸溶解.取少量上层清液,滴加硫氰化钾溶液,若溶液变红即含有Fe2O3;
(4)Na2WO4与浓盐酸反应生成氯化钠和H2WO4,离子方程式为:WO42-+2H+═H2WO4↓,H2WO4易分解为氧化钨和水,属于分解反应,
故答案为:H2WO4;分解反应;
(5)高温条件下,铝与氧化钨反应生成单质钨和氧化铝,其反应方程式为:WO3+2Al
W+Al2O3,实验室引发铝热反应的操作方法是:在混合物上面加少量氯酸钾固体,中间插一根用砂纸打磨过的镁带,用燃着的小木条点燃镁带;
故答案为:WO3+2Al
W+Al2O3;在混合物上面加少量氯酸钾固体,中间插一根用砂纸打磨过的镁带,用燃着的小木条点燃镁带;
(6)根据Ksp(FeWO4)=c(Fe2+)?c(WO42-)=2.5×10-12,Ksp(MnWO4)=7.5×10-16,体积为1L含MnWO4物质的量为0.6mol,c(Fe2+)=
,解得c(Fe2+)=2000mol/L,这种浓度的溶液无法配置,
故答案为:2000;不能.
故答案为:六;
(2)氧化铁和氧化锰不溶于水,钨酸钠易溶于水判断A为钨酸钠,则MnWO4与NaOH反应生成二氧化锰和钨酸钠,反应中锰元素化合价升高作还原剂,氧气作氧化剂,其反应方程式为:2MnWO4+4NaOH+O2
| ||
故答案为:2MnWO4+4NaOH+O2
| ||
(3)实验室检验滤渣中含有Fe2O3的方法是:把氧化铁转化为三价铁离子的溶液,再用硫氰化钾检验,即取少量滤渣于试管中,加适量稀盐酸溶解.取少量上层清液,滴加硫氰化钾溶液,若溶液变红即含有Fe2O3;
故答案为:取少量滤渣于试管中,加适量稀盐酸溶解.取少量上层清液,滴加硫氰化钾溶液,若溶液变红即含有Fe2O3;
(4)Na2WO4与浓盐酸反应生成氯化钠和H2WO4,离子方程式为:WO42-+2H+═H2WO4↓,H2WO4易分解为氧化钨和水,属于分解反应,
故答案为:H2WO4;分解反应;
(5)高温条件下,铝与氧化钨反应生成单质钨和氧化铝,其反应方程式为:WO3+2Al
| ||
故答案为:WO3+2Al
| ||
(6)根据Ksp(FeWO4)=c(Fe2+)?c(WO42-)=2.5×10-12,Ksp(MnWO4)=7.5×10-16,体积为1L含MnWO4物质的量为0.6mol,c(Fe2+)=
| Ksp |
| c(WO42-) |
故答案为:2000;不能.
点评:本题主要考查工业制备流程、金属的冶炼、氧化还原反应和化学计算,并考查学生正确书写化学方程式的能力,一道综合知识的考查题,考查学生分析和解决问题的能力,综合性强,难度中等.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
下列有关苯的叙述中错误的是( )
| A、苯在催化剂作用下能与浓硝酸发生取代反应 |
| B、在一定条件下苯能与氢气气发生加成反应 |
| C、在苯中加入酸性高锰酸钾溶液,振荡并静置后下层液体为紫红色 |
| D、在苯中加入溴水,振荡并静置后下层液体为橙色 |
科学家最近在-100℃的低温下合成了一种结构简式为 的烃X,经红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,绘制了如图所示的球棍模型.下列说法中错误的是( )
的烃X,经红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,绘制了如图所示的球棍模型.下列说法中错误的是( )
 的烃X,经红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,绘制了如图所示的球棍模型.下列说法中错误的是( )
的烃X,经红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,绘制了如图所示的球棍模型.下列说法中错误的是( )| A、烃X的分子式为C5H4 |
| B、分子中碳原子的化学环境有两种 |
| C、1molX在一定条件下可与2mol氢气发生反应 |
| D、X不能使酸性高锰酸钾溶液褪色 |
能正确表示下列反应的离子方程式为( )
| A、碳酸氢钠溶液中滴入氢氧化钙溶液:HCO3-+OH-=CO32-+H2O |
| B、二氧化硫通入次氯酸钠溶液:SO2+ClO-+2OH-=SO42-+Cl-+H2O |
| C、硫化钡加入稀硫酸:BaS+2H+=H2S↑+Ba2+ |
| D、硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓ |
2011年的云南曲靖铬污染事故尚未平息,时隔半年,2012年广西柳州的龙江河镉污染事故再一次令人触目惊心,环境保护刻不容缓.关于
Cr说法正确的是( )
52 24 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|



 2014年10月初,雾霾天气多次肆虐河北、天津、北京等地区.其中,燃煤和汽车尾气是造成空气污染的原因之一.
2014年10月初,雾霾天气多次肆虐河北、天津、北京等地区.其中,燃煤和汽车尾气是造成空气污染的原因之一.