题目内容
1.下列装置或操作能达到实验目的是( )| A. |  量取8.5mL稀硫酸 | B. |  制备Fe(OH)2 | ||
| C. |  防止铁钉生锈 | D. |  用酒精萃取水中的溴 |
分析 A.量取液体的体积与量筒的规格尽量接近,减小误差;
B.煤油可隔绝空气,防止生成的氢氧化亚铁被氧化;
C.Fe为负极失去电子,石墨为正极;
D.酒精与水互溶.
解答 解:A.量取8.5mL稀硫酸,应选择10mL量筒,故A错误;
B.煤油可隔绝空气,防止生成的氢氧化亚铁被氧化,图中制备实验装置合理,故B正确;
C.Fe为负极失去电子,石墨为正极,则加快铁的腐蚀,故C错误;
D.酒精与水互溶,不能作萃取剂,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、反应原理、混合物分离提纯、实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合及实验技能训练,题目难度不大.

练习册系列答案
相关题目
5.综合如图判断,下列正确的说法是( )
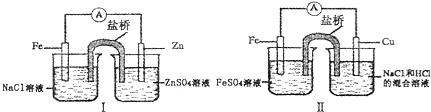

| A. | 装置I和装置II中负极反应均是Fe-2e-═Fe2+ | |
| B. | 装置I和装置II中正极反应均是O2+4e-+2H2O-═4OH- | |
| C. | 装置I和装置II中盐桥中的阳离子均向右侧烧杯移动 | |
| D. | 装置I和装置II中正极均被保护 |
12.甲、乙、丙都是短周期元素,其中甲、乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,丙元素原子K层和M层电子数之积与L层的电子数相同.则下列判断不正确的是( )
| A. | 氢化物的稳定性甲>乙>丙 | |
| B. | 甲、丙元素最高价氧化物对应水化物的酸性强弱顺序为:丙<甲 | |
| C. | 原子半径由大到小的顺序为:甲>乙 | |
| D. | 乙元素的族序数比甲元素的族序数大 |
9.下列化学用语表示正确的是( )
| A. | 甲烷的比例模型: | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 氯化氢的电子式: | D. | S2-的结构示意图: |
16.下列实验装置图正确的是( )
| A. |  工业乙醇的蒸馏 | B. |  苯甲酸趁热过滤 | ||
| C. |  制少量乙炔并测体积 | D. |  实验室制硝基苯 |
6.在一定温度下,反应A2(气)+B2(气)?2AB(气)达到平衡状态的标志是( )
| A. | 单位时间里消耗n molA2,同时生成2n molAB | |
| B. | 容器中的总压强不随时间而变化 | |
| C. | A2、B2、AB的物质的量之比满足1:2:3 | |
| D. | 单位时间里生成2n molAB的同时生成n molB2 |

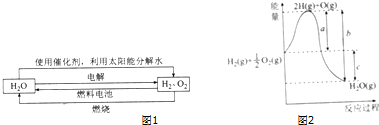 科学家认为氢气是一种高效且无污染的理想能源,近20年来,以氢气为未来的动力燃料的研究获得了迅速发展.
科学家认为氢气是一种高效且无污染的理想能源,近20年来,以氢气为未来的动力燃料的研究获得了迅速发展.