题目内容
18.实验室中,用AlCl3制取氢氧化铝,最适宜用的试剂是( )| A. | NaOH溶液 | B. | 氨水 | C. | Ba(OH)2溶液 | D. | 盐酸 |
分析 制备氢氧化铝应用可溶性铝盐与碱反应,注意生成的氢氧化铝具有两性,能够溶解在强碱中,所以应选择弱碱,据此解答.
解答 解:氢氧化钠、氢氧化钡都是强碱,二者都能够与氢氧化铝反应生成偏铝酸盐,不适合制备氢氧化铝,氨水中的一水合氨为弱碱,能够与氯化铝反应生成氢氧化铝沉淀和氯化铵,反应离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,适合制备氢氧化铝,盐酸与氯化铝不反应,
故选:B.
点评 本题考查了氢氧化铝的制备,明确氢氧化铝为两性能够与强碱反应的性质即可解答,题目难度不大.

练习册系列答案
相关题目
8.实验室保存下列物质的方法中,不正确的是( )
| A. | 少量金属钠保存在煤油里 | |
| B. | 浓硫酸存放在广口试剂瓶中 | |
| C. | FeSO4溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 氯水应装在棕色细口瓶中密封避光保存 |
9.在A、B两个烧杯的溶液中,共含有Fe2+、Na+、H+、NO3-、Cl-、OH-6种离子,已知B烧杯为无色溶液,含有大量的其中三种离子,则A烧杯的溶液中含有大量的另外三种离子是( )
| A. | NO${\;}_{3}^{-}$、OH-、Cl- | B. | Fe2+、OH-、NO${\;}_{3}^{-}$ | ||
| C. | Fe2+、H+、Cl- | D. | Na+、H+、OH- |
6.常温下,下列有关电解质溶液的说法正确的是( )
| A. | pH=3的强酸溶液1mL,加水稀释至100mL后,溶液pH降低2个单位 | |
| B. | pH=2的盐酸中水电离出的H+浓度小于pH=12的氨水中水电离出的OH-浓度 | |
| C. | 0.2molCO2通入1L0.3mol•L-1KOH溶液中:2c(H+)+c(HCO3-)+3c(H2CO3)=2c(OH-)+c(CO32-) | |
| D. | 已知一定浓度的NaHSO3溶液pH=5.4,则c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-) |
13.一种燃料电池如图所示,关于它的说法正确的是( )
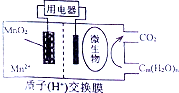

| A. | MnO2极为负极 | |
| B. | Cn(H2O)m发生了氧化反应 | |
| C. | 电子从负极区经交换膜移向正极区 | |
| D. | 放电过程中,H+从正极区移向负极区 |
10.氯化铜溶液中含有少量氯化铁杂质,若要制得纯净的氯化铜,向溶液中加入下列试剂,不能达到目的是( )
| A. | NaOH | B. | CuO | C. | Cu(OH)2 | D. | Cu2(OH)2CO3 |
7.NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 反应3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O中,每生成1molFe3O4时,转移电子数为4NA | |
| B. | 常温常压下,2.24LCO2的质量大于4.4g | |
| C. | 常温下,1L0.1mol•L-1AlCl3溶液中阳离子数目小于0.1NA | |
| D. | 15.6gNa2O2和Na2S固体混合物中,含有阴离子数目大于0.2NA |
2.以下是配制250mL0.2mol•L-1氯化钠溶液的步骤:
①溶解 ②洗涤 ③移液 ④计算 ⑤定容 ⑥称量 ⑦盖好瓶塞,反复上下颠倒,摇匀.请你选出该溶液配制的操作先后顺序是( )
①溶解 ②洗涤 ③移液 ④计算 ⑤定容 ⑥称量 ⑦盖好瓶塞,反复上下颠倒,摇匀.请你选出该溶液配制的操作先后顺序是( )
| A. | ②③⑤①⑥⑦④ | B. | ④⑥①③②⑤⑦ | C. | ④②⑤⑥①③⑦ | D. | ②⑥⑦④③⑤① |