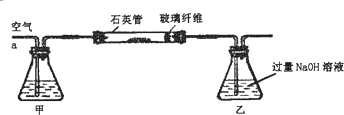
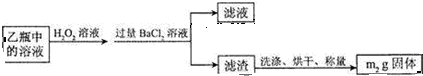
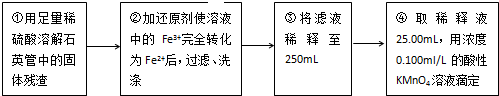
题目内容
1.Cl2在70℃的NaOH水溶液中,能同时发生两个自身氧化还原反应,反应完全后测得溶液中NaClO和NaClO3的物质的量比为6:1,则溶液中NaCl和NaClO的物质的量之比为( )| A. | 9:4 | B. | 6:1 | C. | 7:6 | D. | 11:6 |
分析 由信息可知,发生Cl2+2NaOH=NaClO+NaCl+H2O,3Cl2+6NaOH(热)=NaClO3+5NaCl+3H2O,令溶液中NaClO与NaClO3的物质的量分别为6mol、1mol,根据电子注意守恒计算NaCl的物质的量,以此来解答.
解答 解:由信息可知,发生Cl2+2NaOH=NaClO+NaCl+H2O,3Cl2+6NaOH(热)=NaClO3+5NaCl+3H2O,令溶液中NaClO与NaClO3的物质的量分别为6mol、1mol,
由电子守恒可知,6mol×(1-0)+1mol×(5-0)=n(NaCl)×[0-(-1)],
解得n(NaCl)=11mol,所以该溶液中NaCl与NaClO的物质的量之比为11mol:6mol=11:6,
故选D.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化及电子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
12.短周期元素R、T、Q、W、G在元素周期表中的相对位置如下图所示,其中Q是无机非金属材料的主角.下列判断正确的是( )
| R | ||||
| T | Q | W | G | |
| A. | 离子半径:T<W<G | |
| B. | 最简单气态氢化物的热稳定性:Q<R | |
| C. | 最高价氧化物对应水化物的酸性:Q>W>G | |
| D. | T和G组成的化合物甲溶于水,其水溶液呈中性 |
13.能使水的电离平衡右移,且水溶液显碱性的离子是( )
| A. | H+ | B. | OH- | C. | Al3+ | D. | HCO3- |
11.下列现象或事实不能用同一原理解释的是( )
| A. | 浓硝酸和氯水用棕色试剂瓶保存 | |
| B. | SO2和Na2SO3溶液都能使氯水褪色 | |
| C. | 常温下铁和铂都不溶于浓硝酸 | |
| D. | 硫化钠和亚硫酸钠固体长期暴露在空气中变质 |