题目内容
13.能使水的电离平衡右移,且水溶液显碱性的离子是( )| A. | H+ | B. | OH- | C. | Al3+ | D. | HCO3- |
分析 水的电离方程式为H2O?H++OH-,能使水的电离平衡右移,且水溶液显碱性,说明该离子能和氢离子反应导致溶液中c(H+)<c(OH-),据此分析解答.
解答 解:水的电离方程式为H2O?H++OH-,
A.加入氢离子,抑制了水的电离,水的电离平衡左移,故A错误;
B.加入OH-,溶液中c(OH-)增大,抑制水电离,水的电离平衡左移,故B错误;
C.Al3+和氢氧根离子反应生成氢氧化铝沉淀,促进水电离,导致溶液中c(H+)>c(OH-),溶液呈酸性,故C错误;
D.HCO3-和氢离子反应生成碳酸,促进水电离,导致溶液中c(H+)<c(OH-),溶液呈碱性,故D正确;
故选D.
点评 本题考查水的电离及其影响,题目难度不大,明确加入物质对弱电解质电离影响是解本题关键,注意掌握溶液酸碱性的判断方法.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
4.分类是学习和研究化学的重要方法,下列分类合理的是( )
| A. | H2SO4和NaHSO4都属于酸 | B. | 火碱和纯碱都属于碱 | ||
| C. | KOH和NH3•H2O都属于电解质 | D. | Na2O和Na2O2都属于碱性氧化物 |
1.Cl2在70℃的NaOH水溶液中,能同时发生两个自身氧化还原反应,反应完全后测得溶液中NaClO和NaClO3的物质的量比为6:1,则溶液中NaCl和NaClO的物质的量之比为( )
| A. | 9:4 | B. | 6:1 | C. | 7:6 | D. | 11:6 |
8.下列离子或分子能够在指定的分散系中大量共存的是( )
| A. | 与铝反应生成大量氢气的溶液中:Mg2+、K+、HCO3-、NO3- | |
| B. | 0.1mol/L的NaNO3溶液中:K+、I-、Cl-、SO42- | |
| C. | 铁与稀硫酸反应后的溶液中:[Fe(CN)6]3-、NH4+、Cl-、NO3- | |
| D. | 空气中:SO2、NO、N2、NH3 |
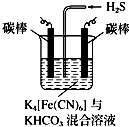 铁及其化合物在工农业生产、环境保护等领域中有着重要的作用.
铁及其化合物在工农业生产、环境保护等领域中有着重要的作用.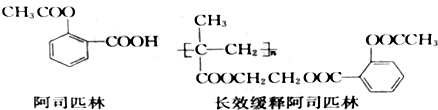
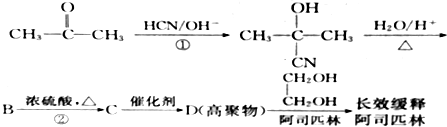
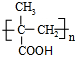
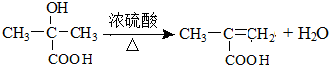
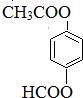 (只写一种)
(只写一种)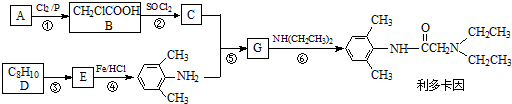
 OH$\stackrel{SOCl_{2}}{→}$R
OH$\stackrel{SOCl_{2}}{→}$R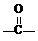 Cl
Cl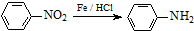
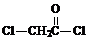 ,⑥的反应类型是取代反应.
,⑥的反应类型是取代反应. .
.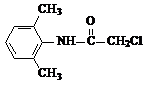 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$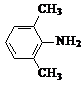 +HOCH2COONa+NaCl.
+HOCH2COONa+NaCl.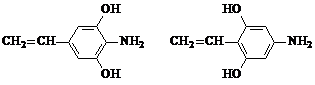 .
.