题目内容
14.在潮湿的空气中,钢铁很快发生电化学腐蚀,在此过程中一定不存在的电极反应是( )| A. | 2H++2e-=H2↑ | B. | Fe-3e-=Fe3+ | ||
| C. | Fe-2e-=Fe2+ | D. | O2+2H2O+4e-=4OH- |
分析 钢铁在潮湿空气中发生电化学腐蚀,可腐蚀吸氧腐蚀或析氢腐蚀,负极上是金属发生失电子的氧化反应,被氧化生产亚铁离子,以此解答该题.
解答 解:A.如发生析氢腐蚀,则正极发生2H++2e-=H2↑,故A正确;
B.负极发生Fe-2e-=Fe2+,故B错误;
C.由B可知发生Fe-2e-=Fe2+,故C正确;
D.如发生吸氧腐蚀,正极发生O2+2H2O+4e-=4OH-,故D正确.
故选B.
点评 本题涉及原电池原理的应用以及金属电化学腐蚀等方面的知识,侧重考查学生的分析能力和双基知识,难度不大,主要把握金属的腐蚀原理.

练习册系列答案
相关题目
2.向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )
| 操作 | 现象 | 结论 | |
| A | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中有SO42- |
| B | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+无K+ |
| C | 滴加氯水和CC14,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| D | 滴加几滴稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
9.已知平衡:①C2H4(g)?C2H2(g)+H2(g),②2CH4(g)?C2H4(g)+2H2(g).当温度升高时,①和②式均向右移动.
a.C(s)+2H2(g)═CH4(g)△H1; b.2C(s)+H2(g)═C2H2(g)△H2;
c.2C(s)+2H2(g)═C2H4(g)△H3;
下列有关a、b和c中△H1、△H2、△H3的大小顺序排列正确的是( )
a.C(s)+2H2(g)═CH4(g)△H1; b.2C(s)+H2(g)═C2H2(g)△H2;
c.2C(s)+2H2(g)═C2H4(g)△H3;
下列有关a、b和c中△H1、△H2、△H3的大小顺序排列正确的是( )
| A. | △H1>△H2>△H3 | B. | △H2>△H3>△H1 | C. | △H2>△H1>△H3 | D. | △H3>△H2>△H1 |
4.NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 46g NO2和N2O4的混合气体中含有的原子个数为3NA | |
| B. | 1 mol Na2O2与水完全反应时转移电子数为2NA | |
| C. | 标准状况下,2.24L庚烷含有的分子数为0.1NA | |
| D. | 1 mol Na2O2中含有的阴离子数为0.2NA |
 a、b、c是原子序数依次增大的三种常见短周期元素.由a、b、c三元素组成的化合物甲的用途如下图所示.a、b、c三元素之间两两化合可生成化合物乙、丙、丁、戊4种.化合物甲、乙、丙、丁、戊之间也能相互反应.已知乙、戊分别是由a、b两元素按原子个数1:1和2:1组成的化合物.若a、b、c三元素形成的单质(仍用a、b、c表示)和由它们组成的化合物之间的反应关系如下(未配平)
a、b、c是原子序数依次增大的三种常见短周期元素.由a、b、c三元素组成的化合物甲的用途如下图所示.a、b、c三元素之间两两化合可生成化合物乙、丙、丁、戊4种.化合物甲、乙、丙、丁、戊之间也能相互反应.已知乙、戊分别是由a、b两元素按原子个数1:1和2:1组成的化合物.若a、b、c三元素形成的单质(仍用a、b、c表示)和由它们组成的化合物之间的反应关系如下(未配平)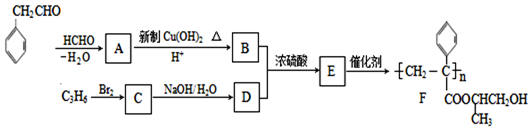
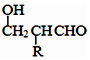 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$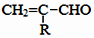
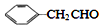 互为同系物,且G物质的相对分子质量比
互为同系物,且G物质的相对分子质量比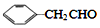 大14的,则符合下列条件的G的同分异构体有9种.
大14的,则符合下列条件的G的同分异构体有9种.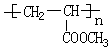 的合成路线
的合成路线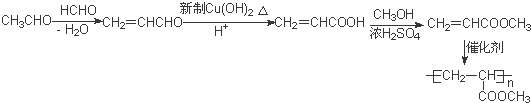 .
.
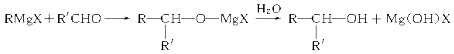
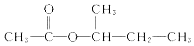 )的流程如下(部分反应物及反应条件没有列出),A主要来源于石油裂解气,A的产量常作为衡量石油化工水平的标志.
)的流程如下(部分反应物及反应条件没有列出),A主要来源于石油裂解气,A的产量常作为衡量石油化工水平的标志.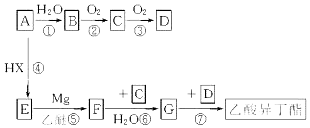
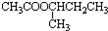 +H2O.
+H2O.