题目内容
10.取1.06g Na2CO3•溶于水配成100ml溶液,求:(1)Na2CO3物质的量浓度0.1mol/L
(2)Na+ 物质的量浓度0.2mol/L
(3)取出20ml该溶液用蒸馏水稀释,使Na2CO3溶液物质的量浓度变为0.04mol/L,取稀释后的Na2CO3溶液30ml加入足量0.1mol/L稀盐酸溶液,最多产生的CO2气体标况下的体积为26.88mL.
分析 (1)根据n=$\frac{m}{M}$计算碳酸钠的物质的量,再根据c=$\frac{n}{V}$计算溶液物质的量浓度;
(2)钠离子物质的量浓度为碳酸钠物质的量浓度的2倍;
(3)溶液是均一的,取出20mL溶液浓度与原溶液浓度相等,根据n=cV计算出取出溶液中含有碳酸钠的物质的量,然后根据C原子守恒计算出生成二氧化碳的物质的量,最后根据V=nVm计算出生成二氧化碳在标准状况下的体积.
解答 解:(1)1.06碳酸钠的物质的量为:$\frac{1.06g}{106g/mol}$=0.01mol,Na2CO3物质的量浓度为:c(Na2CO3)=$\frac{0.01mol}{0.1L}$=0.1mol/L,
故答案为:0.1mol/L;
(2)溶液中Na+ 物质的量浓度为:c(Na+ )=2c(Na2CO3)=0.1mol/L×2=0.2mol/L,
故答案为:0.2mol/L;
(3)溶液是均一的,取出20mL溶液中Na2CO3的浓度与原溶液浓度相等,仍然为0.04mol/L,取出溶液中含有Na2CO3的物质的量为:n(Na2CO3)=0.04mol/L×0.03L=0.0012mol,
盐酸足量,根据C原子守恒可知最多产生的CO2气体的物质的量为:n(CO2)=n(Na2CO3)=0.0012mol,标准状况下0.003mol二氧化碳的体积为:22.4L/mol×0.0012mol=0.02688L=26.88mL,
故答案为:26.88 mL.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的理念的概念及表达式为解答关键,注意掌握稀释定律的内容及应用,试题培养了学生的化学计算能力.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
11.某无色混合气体可能含有CO2、H2、CO和H2O(气)中的一种或几种,依次进行以下处理(假设每次处理均反应完全):①通过盛有硅胶的干燥管时,气体体积不变;②通过炽热的氧化铜时,固体变为红色;③通过白色CuSO4粉末时,粉末变蓝色;④通过澄清石灰水时,溶液变浑浊.则原混合气体的成分不可能是( )
| A. | H2和CO | B. | CO2、H2和CO | C. | H2O | D. | H2和CO2 |
1.下列各组变化中,前者是放热反应,后者是吸热反应的是( )
| A. | 生石灰溶于水;锌粒和稀硫酸反应 | |
| B. | 稀释浓硫酸;金属或金属氧化物熔化 | |
| C. | 氢氧化钠和盐酸反应;二氧化碳和碳反应 | |
| D. | 工业煅烧石灰石;化石燃料燃烧 |
18.室温下,向100mL 0.1mol/L的H2SO4中加入足量的锌粒,若想减慢制取H2的速率,但又不影响H2的体积,向硫酸溶液中加入试剂可以选( )
①硝酸钠溶液 ②醋酸钠溶液③碳酸钠溶液 ④氯化钠溶液.
①硝酸钠溶液 ②醋酸钠溶液③碳酸钠溶液 ④氯化钠溶液.
| A. | ①② | B. | ②④ | C. | ③④ | D. | ①③ |
5.下列离子方程式正确的是( )
| A. | 硫酸氢钠溶液和过量的Ba(OH)2溶液反应SO42-+H++Ba2++OH-=BaSO4↓+H2O | |
| B. | 碳酸氢钠水解:HCO3-+H2O=CO32-+H3O+ | |
| C. | 氯气和水反应:Cl2+H2O=2H++Cl-+ClO- | |
| D. | 用铂电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- |
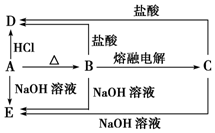 A、B、C、D、E五种物质均含有某种常见金属元素,它们的转化关系如图所示,其中B为白色难溶固体,E易溶于水.
A、B、C、D、E五种物质均含有某种常见金属元素,它们的转化关系如图所示,其中B为白色难溶固体,E易溶于水.