题目内容
 (1)已知2Cu(s)+
(1)已知2Cu(s)+| 1 |
| 2 |
2Cu(s)+S(s)=Cu2S(s);△H2=-79.5kJ/mol
S(s)+O2 (g)=SO2(g);△H3=-296.83kJ/mol
求Cu2S(s)+2Cu2O(s)=6Cu(s)+SO2(g)△H4=
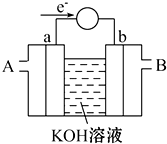
(2)如图为某种燃料电池的工作原理示意图,a、b均为惰性电极.
①使用时,空气从
②假设使用的“燃料”是甲醇,a极的电极反应式为:
b极的电极反应式为:
③假设使用的“燃料”是H2,用这种电池电镀铜,待镀金属增重6.4g,则至少消耗标准状况下H2的体积为
考点:原电池和电解池的工作原理,热化学方程式
专题:化学反应中的能量变化,电化学专题
分析:(1)利用盖斯定律计算反应热;
(2)由电子转移方向可知a为负极,发生氧化反应,应通入燃料,b为正极,发生还原反应,应通入空气,以此解答该题.
(2)由电子转移方向可知a为负极,发生氧化反应,应通入燃料,b为正极,发生还原反应,应通入空气,以此解答该题.
解答:
解:(1)已知:2Cu(s)+
O2(g)=Cu2O(s);△H1=-12.0kJ/mol ①
2Cu(s)+S(s)=Cu2S(s);△H2=-79.5kJ/mol ②
S(s)+O2 (g)=SO2(g);△H3=-296.83kJ/mol ③
根据盖斯定律③-①×2-②可得Cu2S(s)+2Cu2O(s)=6Cu(s)+SO2(g);△H4=-193.33kJ/mol,
故答案为:-193.33;
(2)①由电子转移方向可知a为负极,发生氧化反应,应通入燃料,b为正极,发生还原反应,应通入空气,故答案为:B;
②假设使用的“燃料”是甲醇,a极为负极,发生的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O,b为正极,发生还原反应,电极方程式为O2+4e-+2H2O=4OH-,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O; O2+4e-+2H2O=4OH-;
③假设使用的“燃料”是H2,则负极发生H2+2e-+2OH-=2H2O,用这种电池电镀铜,待镀金属增重6.4g,n(Cu)=
=0.1mol,
转移电子0.2mol,由电极方程式可知消耗0.1molH2,体积为2.24L,
故答案为:2.24L.
| 1 |
| 2 |
2Cu(s)+S(s)=Cu2S(s);△H2=-79.5kJ/mol ②
S(s)+O2 (g)=SO2(g);△H3=-296.83kJ/mol ③
根据盖斯定律③-①×2-②可得Cu2S(s)+2Cu2O(s)=6Cu(s)+SO2(g);△H4=-193.33kJ/mol,
故答案为:-193.33;
(2)①由电子转移方向可知a为负极,发生氧化反应,应通入燃料,b为正极,发生还原反应,应通入空气,故答案为:B;
②假设使用的“燃料”是甲醇,a极为负极,发生的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O,b为正极,发生还原反应,电极方程式为O2+4e-+2H2O=4OH-,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O; O2+4e-+2H2O=4OH-;
③假设使用的“燃料”是H2,则负极发生H2+2e-+2OH-=2H2O,用这种电池电镀铜,待镀金属增重6.4g,n(Cu)=
| 6.4g |
| 64g/mol |
转移电子0.2mol,由电极方程式可知消耗0.1molH2,体积为2.24L,
故答案为:2.24L.
点评:本题考查的知识点较多,题目综合性较强,难度较大,主要考查了盖斯定律的应用、燃料电池等,在书写电池的电极方程式时要注意电解质对反应产物的影响.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列叙述中不正确的是( )
| A、分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA |
| B、0.1molOH-含0.9NA个质子 |
| C、常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数为2 NA |
| D、常温常压下,92g的NO2和N2O4混合气体含有的原子数为6 NA |
 某无色透明溶液,可能含有下列离子:Mg2+、Al3+、Fe3+、Ba2+、H+、NH4+、SO42-、HCO3-、Cl-.取该溶液进行如下实验:
某无色透明溶液,可能含有下列离子:Mg2+、Al3+、Fe3+、Ba2+、H+、NH4+、SO42-、HCO3-、Cl-.取该溶液进行如下实验: