题目内容
4.AB是由短周期元素形成的金属单质,ABC三重金属单质和气体甲乙丙及物质DEFGH之间能发生如下反应(图中有些产物和反应条件没有全部标出)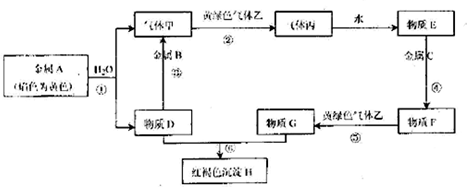
回答:
(1)写出下列物质的化学式:A:Na 乙:Cl2
(2)检验溶液F 中阳离子的方法为取少量溶液于试管中,滴加KSCN溶液无明显现象,再滴加新制氯水,溶液变红,证明金属离子为Fe2+
(3)反应③的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑、反应⑤的离子方程式为:2Fe2++Cl2═2Fe3++2Cl-
(4)上述反应①至⑥中属于氧化还原反应的有①②③④⑤.
分析 金属A焰色反应为黄色,故A为Na,由反应①Na+水→气体甲+D,则甲为H2,D为NaOH,金属B与氢氧化钠反应得到氢气,则B为Al,黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸.氢氧化钠与物质G反应生成红褐色沉淀H是Fe(OH)3,故物质G中含有Fe3+,盐酸与金属C反应得到F,F与氯气反应得到G,可知金属C为Fe,物质F为FeCl2,物质G为FeCl3,据此解答.
解答 解:金属A焰色反应为黄色,故A为Na,由反应①Na+水→气体甲+D,则甲为H2,D为NaOH,金属B与氢氧化钠反应得到氢气,则B为Al,黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸.氢氧化钠与物质G反应生成红褐色沉淀H是Fe(OH)3,故物质G中含有Fe3+,盐酸与金属C反应得到F,F与氯气反应得到G,可知金属C为Fe,物质F为FeCl2,物质G为FeCl3.
(1)由上述分析可知,A为Na,乙为Cl2,故答案为:Na;Cl2;
(2)检验溶液FeCl2 中阳离子的方法为:取少量溶液于试管中,滴加KSCN溶液无明显现象,再滴加新制氯水,溶液变红,证明金属离子为Fe2+,
故答案为:取少量溶液于试管中,滴加KSCN溶液无明显现象,再滴加新制氯水,溶液变红,证明金属离子为Fe2+;
(3)反应③的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,
反应⑤的离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;2Fe2++Cl2═2Fe3++2Cl-;
(4)上述反应①至⑥中,属于氧化还原反应的有①②③④⑤,
故答案为:①②③④⑤.
点评 本题考查无机物推断,涉及Na、Al、Fe、Cl等元素单质及其化合物之间的相互转化,焰色反应、物质颜色是推断突破口,熟练掌握元素化合物性质,难度中等.

| A. | 烷烃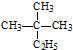 的系统命名为2-甲基-2-乙基丙烷 的系统命名为2-甲基-2-乙基丙烷 | |
| B. | 由石油分馏可以获得石蜡,由石蜡裂化可获得乙烯 | |
| C. | 图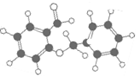 所示的有机物分子式为C14H12O2,能发生银镜反应 所示的有机物分子式为C14H12O2,能发生银镜反应 | |
| D. | 在稀硫酸溶液中,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
| A. | 升高温度能使化学反应速率增大,主要原因是降低了反应活化能 | |
| B. | 有气体参加的化学反应,增大压强一定可以增大化学反应速率 | |
| C. | 增大反应物浓度,可提高单位体积内活化分子的百分数,从而使有效碰撞次数增大 | |
| D. | 催化剂的加入能提高单位体积内活化分子百分数,从而增大化学反应速率 |
| A. | 肾功能衰竭等疾病,可利用血液透析进行治疗 | |
| B. | 在饱和氯化铁溶液中滴加NaOH溶液,产生红褐色沉淀 | |
| C. | 清晨,在茂密的树林中,可看到枝叶间透过的一道光线 | |
| D. | 使用微波手术刀进行外科手术,可使开刀处的血液迅速凝固而减少失血 |
| A. | 水玻璃和硫酸亚铁溶液长期暴露在空气中均易变质 | |
| B. | SO2和CO2通入CaCl2溶液中均无明显现象 | |
| C. | 浓硫酸和浓盐酸长期暴露在空气中浓度降低 | |
| D. | SO2、漂白粉、活性炭都能使红墨水褪色 |
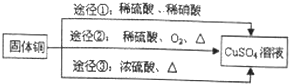
 ,其中还原剂是Cu.上述途径中你认为最佳途径是②,选择的理由是原料利用率高,环境污染小.
,其中还原剂是Cu.上述途径中你认为最佳途径是②,选择的理由是原料利用率高,环境污染小.