题目内容
2.NH4NO3的摩尔质量是80g/mol;0.1mol NH4NO3的质量是8g;其中含氮的物质的量为0.2mol;将这些NH4NO3配成100mL溶液,则溶液中NH4NO3的物质的量浓度为1mol/L.(可能用到的相对原子质量H 1 C 12 N 14 O 16 )
分析 摩尔质量数值上等于相对分子量;根据m=nM进行计算求解;1molNH4NO3中含有2mol的氮原子;根据c=$\frac{n}{V}$进行计算求解.
解答 解:NH4NO3的相对分子量为:80,所以摩尔质量是80g/mol,m=nM=0.1mol×80g/mol=8g;1molNH4NO3中含有2mol的氮原子,所以含氮的物质的量为0.2 mol,根据c=$\frac{n}{V}$=$\frac{0.1mol}{0.1L}$=1mol/l,故答案为:80;8;0.2;1.
点评 本题主要考查的是物质的量的有关计算,学生只要熟悉相关公式之间的转化,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.下列关于食品添加剂的说法不正确的是( )
| A. | 食品添加剂在合理限量范围内使用不影响人体健康 | |
| B. | 食品添加剂必须用天然的物质 | |
| C. | 柠檬黄常用来做着色剂,改善食品色泽 | |
| D. | 醋可用作防腐剂和调味品 |
13.短周期主族元素X、Y、Z、M、N的原子序数依次增大.X和M的原子核外均有两个未成对电子,但不处于同一主族.Y、Z、M最高价氧化物对应的水化物两两之间能相互反应,N和M相邻.下列叙述正确的是( )
| A. | 原子最外层电子数由少到多的顺序:Y、Z、X、M、N | |
| B. | 单质Y的熔点高于单质Z的熔点 | |
| C. | 元素非金属性由弱到强的顺序:M、N、X | |
| D. | 电解N和Y、Z形成的化合物可分别得到对应的Y和Z |
10.下列每组反应一定能用同一离子方程式表示的是( )
| A. | CuO分别与稀硫酸、稀盐酸反应 | |
| B. | CaCO3、Na2CO3分别与盐酸反应 | |
| C. | H2SO4、K2SO4溶液分别与Ba(OH)2溶液反应 | |
| D. | Na分别与水、稀盐酸反应 |
17.已知草酸镍晶体(NiC2O4•2H2O)难溶于水,工业上从废镍催化剂(成分主 要是Ni,含有一定量的Al2O3、Fe、SiO2、CaO等)制备草酸镍晶体的流程如图所示:
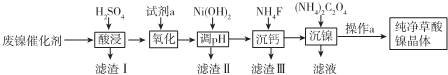
已知:①相关金属离子生成氢氧化物沉淀的pH如表:
②Ksp(CaF2)=1.46×10-10
③当某物质模拟高度小于1.0×10-5mol.L-1时,视为完全沉淀.
(1)请写出一种能提高酸浸速率的措施把废镍催化剂粉碎或适当加热、适当增大硫酸浓度、搅拌等.
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)pH的调控范围为5.0~6.8,试用化学反应原理的相关知识解释滤渣Ⅱ的生成.5.6~6.8
(4)写出“沉镍”时反应的离子方程式Ni2++C2O42-+2H2O=NiC2O4•2H2O,证明Ni2+已经沉淀完全的实验步骤及现象是取上层清液,继续滴加(NH4)2C2O4溶液,无沉淀生成,
(5)操作a的内容为过滤、洗涤、干燥.

已知:①相关金属离子生成氢氧化物沉淀的pH如表:
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
| 开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
| 完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
③当某物质模拟高度小于1.0×10-5mol.L-1时,视为完全沉淀.
(1)请写出一种能提高酸浸速率的措施把废镍催化剂粉碎或适当加热、适当增大硫酸浓度、搅拌等.
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)pH的调控范围为5.0~6.8,试用化学反应原理的相关知识解释滤渣Ⅱ的生成.5.6~6.8
(4)写出“沉镍”时反应的离子方程式Ni2++C2O42-+2H2O=NiC2O4•2H2O,证明Ni2+已经沉淀完全的实验步骤及现象是取上层清液,继续滴加(NH4)2C2O4溶液,无沉淀生成,
(5)操作a的内容为过滤、洗涤、干燥.
7.一元酸HA溶液中,加入一定量强碱MOH溶液后,恰好完全反应,反应后的溶液中,下列判断正确的是( )
| A. | c(A-)≥c(M+) | B. | c(A-)≤c(M+) | ||
| C. | 若MA不水解,则c(OH-)=c(A-) | D. | 若MA水解,则c( OH-)>c(A-) |
14.一块质量为0.92g金属钠投入到100ml物质的量浓度0.1mol/l的AlCl3溶液中,反应得到的生成物是( )
| A. | H2、Al(OH)3 | B. | H2、NaAlO2 | C. | H2、NaAlO2、NaCl | D. | H2、Al(OH)3、NaCl |
11.500mL 1mol/L FeCl3溶液与200mL 1mol/L KCl溶液中的Cl-物质的量浓度之比( )
| A. | 5:2 | B. | 3:1 | C. | 15:2 | D. | 1:3 |