题目内容
11.500mL 1mol/L FeCl3溶液与200mL 1mol/L KCl溶液中的Cl-物质的量浓度之比( )| A. | 5:2 | B. | 3:1 | C. | 15:2 | D. | 1:3 |
分析 由化学式可知FeCl3溶液中氯离子浓度为氯化铁浓度的3倍,KC1溶液中Cl-的物质的量浓度与氯化钾浓度相等.
解答 解:1mol/L的FeCl3溶液中氯离子浓度为1mol/L×3=3mol/L,
1mol/L的KC1溶液中Cl-的物质的量浓度为1mol/L,
故1mol/L的FeCl3溶液与1mol/L的KC1溶液中Cl-的物质的量浓度之比为3mol/L:1mol/L=3:1,
故选B.
点评 考查物质的量浓度的有关计算,比较基础,电解质溶液中离子浓度=电解质浓度×化学式中离子数目,与溶液体积无关.

练习册系列答案
相关题目
6.常温下,取0.2mol•L-1HX溶液与0.2mol•L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则下列说法(或关系式)不正确的是( )
| A. | 混合溶液中由水电离出的c(OH-)═10-8 mol•L-1 | |
| B. | c(Na+)═c(X-)+c(HX)=0.1mol•L-1 | |
| C. | c(Na+)-c(X-)═9.9×10-7mol•L-1 | |
| D. | c(OH-)-c(HX)═c(H+)=1×10-8mol•L-1 |
16. 目前流行的关于生命起源假设的理论认为,生命起源于约40亿年前的古洋底的热液环境,这种环境系统中普遍存在铁硫簇结构,如Fe2S2、Fe4S4、Fe8S7等,这些铁硫簇结构参与了生命起源的相关反应.某化学兴趣小组在研究某铁硫簇结构的组成时,设计了下列实验.
目前流行的关于生命起源假设的理论认为,生命起源于约40亿年前的古洋底的热液环境,这种环境系统中普遍存在铁硫簇结构,如Fe2S2、Fe4S4、Fe8S7等,这些铁硫簇结构参与了生命起源的相关反应.某化学兴趣小组在研究某铁硫簇结构的组成时,设计了下列实验.
[实验I]确定硫的质量:
按图连接装置,检查好装置的气密性后,在硬质玻璃管A中放入1.0g铁硫簇结构(含有部分不反应的杂质),在试管B中加入50mL 0.100mol•L-1的酸性KMn04溶液,在试管C中加入品红溶液.通入空气并加热,发现固体逐渐转变为红棕色.待固体完全转化后,将B中溶液转移至250mL容量瓶,洗涤试管B后定容.取25.00mL该溶液用0.01mol•L-1的草酸(H2C204)溶液滴定剩余的KMn04.记录数据如下:
相关反应:①2MnO4-+2H20+5S02═2Mn2++5S042-+4H+
②2MnO4-+6H++5H2C2O4═2Mn2++l0CO2↑+8H20
[实验Ⅱ]确定铁的质量:
将实验I硬质玻璃管A中的残留固体加入稀盐酸中,充分搅拌后过滤,在滤液中加入足量的NaOH溶液,过滤后取滤渣,经充分灼烧得0.6g固体.
试回答下列问题:
(1)实验I中判断滴定终点的方法是加入最后一滴草酸,溶液紫色褪去,且半分钟不变色.
(2)实验I中,试管C中品红溶液的作用是检验二氧化硫是否被酸性高锰酸钾完全吸收.
有同学提出,撤去C装置对实验没有影响,你的看法是同意(选填“同意”或“不同意”),理由是若B中高锰酸钾溶液的紫色不褪去,说明二氧化硫被吸收完全.
(3)根据实验I和实验Ⅱ中的数据可确定该铁硫簇结构的化学式为Fe3S4.
[问题探究]滴定过程中,细心的小明发现该KMnO4溶液颜色褪去的速率较平常滴定时要快
得多.为研究速率加快的原因,小明继续进行了下列实验,实验数据如下表:
(4)分析上述数据知,滴定过程中反应速率较平常滴定时要快的一种可能原因是生成锰离子对反应起催化作用(或反应放热使温度升高,加快反应速率).
 目前流行的关于生命起源假设的理论认为,生命起源于约40亿年前的古洋底的热液环境,这种环境系统中普遍存在铁硫簇结构,如Fe2S2、Fe4S4、Fe8S7等,这些铁硫簇结构参与了生命起源的相关反应.某化学兴趣小组在研究某铁硫簇结构的组成时,设计了下列实验.
目前流行的关于生命起源假设的理论认为,生命起源于约40亿年前的古洋底的热液环境,这种环境系统中普遍存在铁硫簇结构,如Fe2S2、Fe4S4、Fe8S7等,这些铁硫簇结构参与了生命起源的相关反应.某化学兴趣小组在研究某铁硫簇结构的组成时,设计了下列实验.[实验I]确定硫的质量:
按图连接装置,检查好装置的气密性后,在硬质玻璃管A中放入1.0g铁硫簇结构(含有部分不反应的杂质),在试管B中加入50mL 0.100mol•L-1的酸性KMn04溶液,在试管C中加入品红溶液.通入空气并加热,发现固体逐渐转变为红棕色.待固体完全转化后,将B中溶液转移至250mL容量瓶,洗涤试管B后定容.取25.00mL该溶液用0.01mol•L-1的草酸(H2C204)溶液滴定剩余的KMn04.记录数据如下:
| 滴定次数 | 待测溶液体积/mL | 草酸溶液体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.50 | 23.70 |
| 2 | 25.00 | 1.02 | 26.03 |
| 3 | 25.00 | 0.00 | 24.99 |
②2MnO4-+6H++5H2C2O4═2Mn2++l0CO2↑+8H20
[实验Ⅱ]确定铁的质量:
将实验I硬质玻璃管A中的残留固体加入稀盐酸中,充分搅拌后过滤,在滤液中加入足量的NaOH溶液,过滤后取滤渣,经充分灼烧得0.6g固体.
试回答下列问题:
(1)实验I中判断滴定终点的方法是加入最后一滴草酸,溶液紫色褪去,且半分钟不变色.
(2)实验I中,试管C中品红溶液的作用是检验二氧化硫是否被酸性高锰酸钾完全吸收.
有同学提出,撤去C装置对实验没有影响,你的看法是同意(选填“同意”或“不同意”),理由是若B中高锰酸钾溶液的紫色不褪去,说明二氧化硫被吸收完全.
(3)根据实验I和实验Ⅱ中的数据可确定该铁硫簇结构的化学式为Fe3S4.
[问题探究]滴定过程中,细心的小明发现该KMnO4溶液颜色褪去的速率较平常滴定时要快
得多.为研究速率加快的原因,小明继续进行了下列实验,实验数据如下表:
| 编号 | 温度/℃ | 酸化的H2C2O4溶液/mL | KMnO4溶液/mL | 溶液褪色时间/s |
| 1 | 25 | 5.0 | 2.0 | 40 |
| 2 | 25 | 5.0(另加少量可溶于水的MnSO4粉末) | 2.0 | 4 |
| 3 | 60 | 5.0 | 2.0 | 25 |
3.下列说法正确的是( )
| A. | 7.8gNa2S和Na2O2的固体混合物中含有的阴离子数目为0.1NA | |
| B. | 用铜做电极电解CuSO4溶液的反应方程式:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| C. | 等质量的N2和CO所含原子数均为2NA | |
| D. | pH等于2的醋酸溶液中加入0.01mol/L的盐酸,溶液pH会变小 |
20.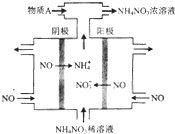 氮可形成多种氧化物,如NO、NO2、N2O4等.
氮可形成多种氧化物,如NO、NO2、N2O4等.
(1)电解NO制备NH4NO3,其工作原理如图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是NH3,理由是:根据反应:8NO+7H2O$\frac{\underline{\;电解\;}}{\;}$3NH4NO3+2HNO3,电解产生的硝酸多,需补充NH3.
(2)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O.含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3?)、c(NO2?)和c(CH3COO?)由大到小的顺序为c(NO3-)>c(NO2-)>c(CH3COO-)(已知HNO2的电离常数Ka=7.1×10-4mol/L,CH3COOH的电离常数Ka=1.7×10-5mol/L).可使溶液A和溶液B的pH相等的方法是bc.
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(3)100℃时,将0.400mol 的NO2气体充入2L抽空的密闭容器中,发生反应2NO2(g)?N2O4(g)△H<0.每隔一定时间就对该容器内的物质进行分析,得到如下表所示数据.
①在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为0.15mol/(L.min);n3=n4(填“>”、“<”或“=”),该反应的平衡常数的值为2.8.
②若在相同条件下,最初向该容器充入的是N2O4气体,达到上述同样的平衡状态,则N2O4的起始浓度是0.1mol/L;假设从放入N2O4到平衡时需要80s,则达到平衡时四氧化二氮的转化率为60%.
 氮可形成多种氧化物,如NO、NO2、N2O4等.
氮可形成多种氧化物,如NO、NO2、N2O4等.(1)电解NO制备NH4NO3,其工作原理如图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是NH3,理由是:根据反应:8NO+7H2O$\frac{\underline{\;电解\;}}{\;}$3NH4NO3+2HNO3,电解产生的硝酸多,需补充NH3.
(2)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O.含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3?)、c(NO2?)和c(CH3COO?)由大到小的顺序为c(NO3-)>c(NO2-)>c(CH3COO-)(已知HNO2的电离常数Ka=7.1×10-4mol/L,CH3COOH的电离常数Ka=1.7×10-5mol/L).可使溶液A和溶液B的pH相等的方法是bc.
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(3)100℃时,将0.400mol 的NO2气体充入2L抽空的密闭容器中,发生反应2NO2(g)?N2O4(g)△H<0.每隔一定时间就对该容器内的物质进行分析,得到如下表所示数据.
| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
②若在相同条件下,最初向该容器充入的是N2O4气体,达到上述同样的平衡状态,则N2O4的起始浓度是0.1mol/L;假设从放入N2O4到平衡时需要80s,则达到平衡时四氧化二氮的转化率为60%.
1.下列反应中,过氧化钠既不作氧化剂也不作还原剂的是( )
| A. | 2Na2O2+2H2O═4NaOH+O2↑ | |
| B. | 2Na2O2+2CO2═2NaCO3+O2 | |
| C. | Na2O2+H2SO4(稀)═Na2SO4+H2O2 | |
| D. | Fe2O3+3Na2O2(熔融)═2Na2FeO4十Na2O |