题目内容
9.下列溶液中导电性最强的是( )| A. | 1L 0.2mol•L-1 醋酸 | B. | 0.1L 0.1mol•L-1 H2SO4溶液 | ||
| C. | 0.5L 0.1mol•L-1 盐酸 | D. | 2L 0.1mol•L-1 H2SO3溶液 |
分析 溶液的导电性取决于溶液离子浓度大小,离子浓度越大,则导电性越强,以此解答.
解答 解:A、醋酸为弱电解质,不能完全离子,溶液中阴阳离子总浓度小于0.4moL/L,也小于0.3mol/L;
B、0.1mol/LH2SO4溶液中阴阳离子总浓度等于0.3mol/L;
C、0.1mol/L 盐酸中阴阳离子总浓度等于0.2mol/L;
D、0.1mol/LH2SO3溶液不能完全电离,如第一步完全电离,则阴阳离子总浓度略大于0.2mol/L;
则离子浓度最大的为B,导电性应最强,
故选:B.
点评 本题考查电解质溶液的导电性强弱的比较,难度不大,注意把握电解质的强弱以及溶液总离子浓度的大小比较.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
20.下列有关物质的分类全部正确的一组是( )
| 非电解质 | 混合物 | 氧化物 | 弱电解质 | |
| A | Cu | 淀粉 | CuO | HClO |
| B | SO3 | 水玻璃 | Na2O•CaO•6SiO2 | H3PO4 |
| C | CH3CH2OH | KAl(SO4)2•12H2O | KClO3 | NH3•H2O |
| D | 葡萄糖 | 普通玻璃 | H2O | H2S |
| A. | A | B. | B | C. | C | D. | D |
4.对Na2O2与CO2方和H2O(g)混合气体的反应来说,下列说法错误的是.
| A. | 只要参加反应的Na2O2的物质的量一定,反应生成的氧气的量就一定 | |
| B. | 只要CO2和H2O(g)的中的物质的量一定,反应所消耗的Na2O2的量就一定 | |
| C. | 只要混合气体的总的物质量一定,反应中所转移的电子的物质的量就一定 | |
| D. | 只要混合气体的总的物质的量一定,固体所增加的质量就一定 |
12.下列元素的第一电离能最大的是( )
| A. | 铝 | B. | 硅 | C. | 磷 | D. | 硫 |
9.中学常见的某反应的化学方程式为a+b→c+d+H2O(未配平,反应条件略去).下列叙述不正确的是( )
| A. | 若a是铁,b是稀硝酸(过量)且a可溶于c溶液中.则a与b反应的离子方程式为Fe+4H++NO3-=Fe3++NO↑+2H2O | |
| B. | 若c,d为气体,且都能使澄清石灰水变浑浊,则将此混合气体通入溴水中,橙色褪去,其褪色过程的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br- | |
| C. | 若c是无色刺激性气味的气体,其水溶液显弱碱性,在标准状况下用排空气法收集c气体得平均摩尔质量为20 g•mol-1的混合气体进行喷泉实验.假设溶质不扩散,实验完成后所得溶液的物质的量浓度约为0.056 mol•L-1 | |
| D. | 若a是造成温室效应的主要气体之一,c、d均为钠盐,参加反应的a、b物质的量之比为4:5,则上述反应的离子方程式为4CO2+5OH-=CO32-+3HCO3-+H2O |
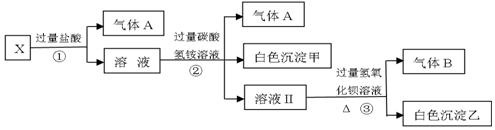
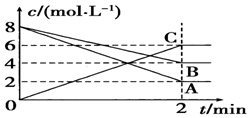 某温度时,在2L密闭容器中,某一化学反应中A、B的物质的量随时间变化的曲线如图所示,由图中数据分析得:
某温度时,在2L密闭容器中,某一化学反应中A、B的物质的量随时间变化的曲线如图所示,由图中数据分析得: