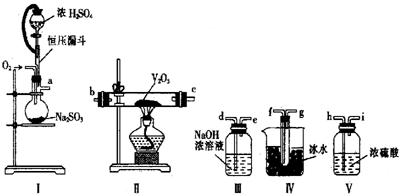
题目内容
1.用KMnO4酸性溶液处理Cu2S固体时,发生如下反应:MnO4-+Cu2S+H+→Cu2++SO2+Mn2++H2O(未配平).下列说法正确的是( )| A. | 该离子反应配平后H2O的系数22 | |
| B. | MnO4-是氧化剂,既Cu2S是氧化剂又是还原剂 | |
| C. | 氧化性:MnO4-<Cu2+ | |
| D. | 生成2.24L(标况下)SO2时反应中转移电子的物质的量是0.6 mol |
分析 MnO4-+Cu2S+H+→Cu2++SO2+Mn2++H2O中,Mn元素的化合价降低,Cu、S元素的化合价升高,配平后的方程式为8MnO4-+5Cu2S+44H+═10Cu2++5SO2+8Mn2++22H2O,结合方程式解答该题.
解答 解:A.配平后的方程式为8MnO4-+5Cu2S+44H+═10Cu2++5SO2+8Mn2++22H2O,可知H2O的系数22,故A正确;
B.Cu、S元素的化合价升高,Cu2S是还原剂,故B错误;
C.氧化剂氧化性大于氧化产物,应为MnO4->Cu2+,故C错误;
D.由方程式可知生成5mol二氧化硫,有8molMnO4-参加反应,转移40mol电子,则生成0.1mol二氧化硫,转移0.8mol电子,故D错误.
故选A.
点评 本题考查了氧化还原反应的概念分析判断,为高频考点,侧重于学生的分析能力和计算能力的熬成,解题关键是化合价变化的分析和规律的应用,题目难度中等.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
20.下列有关物质的分类全部正确的一组是( )
| 非电解质 | 混合物 | 氧化物 | 弱电解质 | |
| A | Cu | 淀粉 | CuO | HClO |
| B | SO3 | 水玻璃 | Na2O•CaO•6SiO2 | H3PO4 |
| C | CH3CH2OH | KAl(SO4)2•12H2O | KClO3 | NH3•H2O |
| D | 葡萄糖 | 普通玻璃 | H2O | H2S |
| A. | A | B. | B | C. | C | D. | D |
12.下列元素的第一电离能最大的是( )
| A. | 铝 | B. | 硅 | C. | 磷 | D. | 硫 |
9.中学常见的某反应的化学方程式为a+b→c+d+H2O(未配平,反应条件略去).下列叙述不正确的是( )
| A. | 若a是铁,b是稀硝酸(过量)且a可溶于c溶液中.则a与b反应的离子方程式为Fe+4H++NO3-=Fe3++NO↑+2H2O | |
| B. | 若c,d为气体,且都能使澄清石灰水变浑浊,则将此混合气体通入溴水中,橙色褪去,其褪色过程的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br- | |
| C. | 若c是无色刺激性气味的气体,其水溶液显弱碱性,在标准状况下用排空气法收集c气体得平均摩尔质量为20 g•mol-1的混合气体进行喷泉实验.假设溶质不扩散,实验完成后所得溶液的物质的量浓度约为0.056 mol•L-1 | |
| D. | 若a是造成温室效应的主要气体之一,c、d均为钠盐,参加反应的a、b物质的量之比为4:5,则上述反应的离子方程式为4CO2+5OH-=CO32-+3HCO3-+H2O |
16.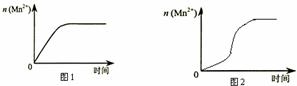 某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
请回答
(1)补充上表中的实验数据:V1=3.0mL,V2=1.0mL,由表中数据可以得到的结论是 其他条件相同时,增大KMnO4浓度反应速率增大
(2)利用实验 1 中数据计算,用 KMnO4 的浓度变化表示的反应速率为 v(KMnO4)=1.5×10-2mol/(L•min)
(3)该小组同学根据经验绘制了 n(Mn2+)随时间变化趋势的示意图,如图 1 所示.但有同学查阅已有实验资 料发现,该实验过程中 n(Mn2+)随时间变化趋势应如图 2 所示,该小组同学根据图 2 所示信息提出了新的假 设,并继续进行实验探究
①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用)
②请你帮助该小组同学完成实验方案,并填写表中空白.
③若该小组同学提出的假设成立,应观察到的现象是 与实验1比较,溶液褪色所需时间短(或所用时间(t)小于4min).
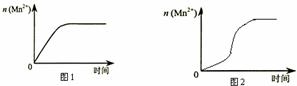 某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2mol/L KMnO4溶液 | 3 mol/L 稀H2SO4 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | V1 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | V2 | ||
(1)补充上表中的实验数据:V1=3.0mL,V2=1.0mL,由表中数据可以得到的结论是 其他条件相同时,增大KMnO4浓度反应速率增大
(2)利用实验 1 中数据计算,用 KMnO4 的浓度变化表示的反应速率为 v(KMnO4)=1.5×10-2mol/(L•min)
(3)该小组同学根据经验绘制了 n(Mn2+)随时间变化趋势的示意图,如图 1 所示.但有同学查阅已有实验资 料发现,该实验过程中 n(Mn2+)随时间变化趋势应如图 2 所示,该小组同学根据图 2 所示信息提出了新的假 设,并继续进行实验探究
①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用)
②请你帮助该小组同学完成实验方案,并填写表中空白.
| 实验 编号 | 室温下,试管中所加试剂及其用量/mL | 在向试管中加 入少量固体 | 室 温 下溶液颜 色 褪 至 无 色 所 需时间/min | |||
| 0.6mol/L H2C2O4 溶液 | H2O | 0.2mol/L KMnO4 溶液 | mol/L 稀 硫酸 | |||
| 4 | 3.0 | 2.0 | 2.0 | t | ||
13.下列关于化学键及晶体的说法中,不正确的是( )
| A. | Cl2、Br2、I2的沸点逐渐升高,是因为分子间作用力越来越大 | |
| B. | NaOH和NH4Cl化学键类型相同 | |
| C. | N2和CCl4两种分子中,每个原子的最外层都具有8电子稳定结构 | |
| D. | 石英晶体是原子晶体,其分子式为SiO2 |
11.下列物质的水溶液因水解而呈酸性的是( )
| A. | HCl | B. | NH4Cl | C. | Na2CO3 | D. | NaCl |