题目内容
6.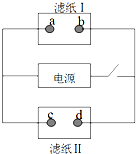 如图中滤纸Ⅰ上浸有饱和食盐水和酚酞,滤纸Ⅱ上浸有KMnO4溶液,接通电源一段时间后,发现a点附近变红,则下列说法中正确的是( )
如图中滤纸Ⅰ上浸有饱和食盐水和酚酞,滤纸Ⅱ上浸有KMnO4溶液,接通电源一段时间后,发现a点附近变红,则下列说法中正确的是( )| A. | a点和电源正极相连 | B. | b点发生还原反应 | ||
| C. | c点附近pH减小 | D. | d点附近颜色加深 |
分析 有外接电源的装置是电解池,接通电源一段时间后,发现a点附近变红,说明a为阴极,阴极上水电解生成氢气和氢氧根离子,则b是阳极,电源右端为正极,左端为负极,d为阳极,c是阴极,据此分析.
解答 解:有外接电源的装置是电解池,接通电源一段时间后,发现a点附近变红,说明a为阴极,阴极上水电解生成氢气和氢氧根离子,则b是阳极,电源右端为正极,左端为负极,d为阳极,c是阴极,
A.由分析可知,a为阴极,与电源的正极相连,故A错误;
B.由分析可知,b是阳极,阳极上发生氧化反应,故B错误;
C.c是阴极,阴极上氢离子得电子生成氢气,所以c点附近氢离子浓度减小,则c点附近pH增大,故C错误;
D.d为阳极,高锰酸根离子向阳极移动,所以阳极附近的颜色加深,即d点附近颜色加深,故D正确.
故选D.
点评 本题考查了电解池原理,明确电解氯化钠溶液时溶液中的离子放电顺序是解本题的关键,题目难度不大,注意把握阴阳极和正负极的判断.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
17.水热法制备飚04纳米颗粒的总反应为:3Fe2++2S2O32-+O2+xOH一═Fe2O4+S4O62-+2H2O,下列说法正确的是( )
| A. | x=2 | |
| B. | Fe2+、S2O32-都是还原剂 | |
| C. | 硫元素被氧化,铁元素被还原 | |
| D. | 每生成1 mol Fe2O4,则转移电子数为3 mol |
14.下列物质不能通过化合反应制得的是( )
| A. | Al(OH)3 | B. | Fe(OH)3 | C. | Na2O | D. | FeCl2 |
11.二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:
(1)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:Na2CO3+H2S═NaHCO3+NaHS.
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)?CH3OH(g);△H=-90.8kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g);△H=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g);△H=-41.3kJ•mol-1
总反应:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)的△H=-246.4kJ•mol-1;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是a、c、e(填字母代号).
a.压缩体积 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(3)已知反应②2CH3OH(g)?CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小:v正> v逆 (填“>”、“<”或“=”).
②温度升高,该反应的平衡常数K减小(填“增大”、“减小”或“不变”)
(1)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:Na2CO3+H2S═NaHCO3+NaHS.
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)?CH3OH(g);△H=-90.8kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g);△H=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g);△H=-41.3kJ•mol-1
总反应:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)的△H=-246.4kJ•mol-1;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是a、c、e(填字母代号).
a.压缩体积 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(3)已知反应②2CH3OH(g)?CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
②温度升高,该反应的平衡常数K减小(填“增大”、“减小”或“不变”)
16.市场销售的某种食用精制盐包装袋上有如下说明:
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,
kI O3+5KI+3H2 SO4=3K2 SO4+3I2+3H2O
上述反应生成的I2可用四氯化碳检验:确认有I2生成的现象是CCl4层呈紫色
利用Na2SO3稀溶液,将I2还原,可从碘的四氯化碳溶液中回收四氯化碳.Na2SO3稀溶液与I2反应的离子方程式为I2+SO32-+H2O=2I-+SO42-+2H+.
(2)已知:I2+2S2O32-=2I-+S4O62-某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解:
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中恰好完全反应依据的现象是滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色.
②b中反应所产生的I2的物质的量是多少?(写出计算过程)
③根据以上实验和包装袋说明测得精制盐的碘(I)含量(以含w的代数式表示,单位为mg/kg).(写出计算过程)
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装日期 | |
| 分装企业 |
kI O3+5KI+3H2 SO4=3K2 SO4+3I2+3H2O
上述反应生成的I2可用四氯化碳检验:确认有I2生成的现象是CCl4层呈紫色
利用Na2SO3稀溶液,将I2还原,可从碘的四氯化碳溶液中回收四氯化碳.Na2SO3稀溶液与I2反应的离子方程式为I2+SO32-+H2O=2I-+SO42-+2H+.
(2)已知:I2+2S2O32-=2I-+S4O62-某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解:
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中恰好完全反应依据的现象是滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色.
②b中反应所产生的I2的物质的量是多少?(写出计算过程)
③根据以上实验和包装袋说明测得精制盐的碘(I)含量(以含w的代数式表示,单位为mg/kg).(写出计算过程)

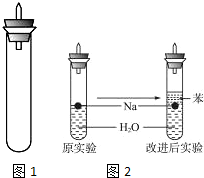 某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸;②Na+水;③Al+NaOH溶液.为点燃上述三个反应生成的H2,他们设计了如图1所示的装置图:
某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸;②Na+水;③Al+NaOH溶液.为点燃上述三个反应生成的H2,他们设计了如图1所示的装置图: