题目内容
15.工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)为原料制备高档颜料--铁红(Fe2O3),具体生产流程如下:
试回答下列问题:
(1)“酸溶”过程中Fe3O4发生反应的离子反应方程式为Fe3O4+8H+=Fe2++2Fe3++4H2O;
(2)实验室实现“步骤Ⅱ”中分离操作所用的玻璃仪器有漏斗、玻璃棒和烧杯等;步骤Ⅳ中应选用D试剂调节溶液的pH(填字母编号).
A.稀硝酸 B.氢氧化钠溶液 C.高锰酸钾溶液 D.氨水
(3)检验步骤Ⅲ已经进行完全的试剂是KSCN溶液;
(4)步骤Ⅴ的反应温度一般需控制在35℃以下,其目的是防止NH4HCO3分解,减少Fe2+的水解;
(5)步骤Ⅵ中发生反应的化学反应方程式为4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2;
(6)步骤Ⅴ中,FeCO3达到沉淀溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10-6 mol/L.试判断所得的FeCO3中是否含有Fe(OH)2否(填“是”或“否”),请通过简单计算说明理由.(已知:Ksp[Fe(OH)2]=4.9×10-17)溶液中c(Fe2+)•c(OH-)2=1×10-6×(1×10-5.5)2=1×10-17<Ksp[Fe(OH)2]=4.9×10-17,故无Fe(OH)2沉淀生成.
(7)欲测定硫铁矿矿渣中Fe元素的质量分数,称取ag样品,充分“酸溶”、“水溶”后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得残留固体bg,测得该样品中Fe元素的质量分数为$\frac{70b}{a}$%.
分析 硫铁矿烧渣加入硫酸后金属氧化物反应生成硫酸亚铁、硫酸铁,酸性氧化物SiO2不能发生反应,过滤后得到的滤渣为二氧化硅,滤液中加入过量铁粉,硫酸铁发生反应生成硫酸亚铁溶液,调节pH后加入碳酸氢铵溶液,可生成碳酸亚铁固体,经洗涤、干燥,在空气中灼烧时发生分解,且与空气中的氧气发生氧化还原反应,可生成氧化铁.(1)酸溶过程中四氧化三铁和酸反应生成亚铁离子、铁离子和水;
(2)根据分析可知,步骤Ⅱ为过滤,过滤操作所用的玻璃仪器有漏斗、玻璃棒和烧杯等,步骤Ⅳ中调节pH值的试剂要能与酸反应且不引入新的杂质,由于加入了NH4HCO3溶液,所以溶液中含有NH4+;
(3)步骤Ⅲ是将铁离子还原成亚铁离子,检验步骤Ⅲ已经进行完全,即溶液中没有铁离子;
(4)步骤Ⅴ是加入碳酸氢铵产生碳酸亚铁溶液,温度过高,亚铁离子水解程度增大,同时加入的碳酸氢铵不稳定,受热容易分解;
(5)步骤Ⅵ中发生反应为碳酸亚铁在空气中与氧气发生氧化还原反应,可生成氧化铁;
(6)由题中数据可知,溶液中c(Fe2+)•c2(OH-)=1×10-6×(1×10-5.5)2=1×10-17<Ksp[Fe(OH)2]=4.9×10-17,故无Fe(OH)2沉淀生成;
(7)根据题意,最后称得残留固体bg为氧化铁,可计算铁元素的质量,由铁元素守恒可知样品中铁元素的质量,以此计算质量分数.
解答 解:硫铁矿烧渣加入硫酸后金属氧化物反应生成硫酸亚铁、硫酸铁,酸性氧化物SiO2不能发生反应,过滤后得到的滤渣为二氧化硅,滤液中加入过量铁粉,硫酸铁发生反应生成硫酸亚铁溶液,调节pH后加入碳酸氢铵溶液,可生成碳酸亚铁固体,经洗涤、干燥,在空气中灼烧时发生分解,且与空气中的氧气发生氧化还原反应,可生成氧化铁.(1)酸溶过程中四氧化三铁和酸反应生成亚铁离子、铁离子和水,“酸溶”过程中Fe3O4发生反应的离子方程式为Fe3O4+8H+=Fe2++2Fe3++4H2O,
故答案为:Fe3O4+8H+=Fe2++2Fe3++4H2O;
(2)根据分析可知,步骤Ⅱ为过滤,过滤操作所用的玻璃仪器有漏斗、玻璃棒和烧杯等,步骤Ⅳ中调节pH值的试剂要能与酸反应且不引入新的杂质,由于加入了NH4HCO3溶液,所以溶液中含有NH4+,故用氨水较好,选项D正确,
故答案为:漏斗;D;
(3)步骤Ⅲ是将铁离子还原成亚铁离子,检验步骤Ⅲ已经进行完全,即溶液中没有铁离子,可以用KSCN溶液.故答案为:KSCN溶液;
(4)步骤Ⅴ是加入碳酸氢铵产生碳酸亚铁溶液,温度过高,亚铁离子水解程度增大,同时加入的碳酸氢铵不稳定,受热容易分解,所以温度一般需控制在35℃以下,
故答案为:防止NH4HCO3分解,减少Fe2+的水解;
(5)步骤Ⅵ中发生反应为碳酸亚铁在空气中与氧气发生氧化还原反应,可生成氧化铁,反应方程式为4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2,
故答案为:4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2;
(6)由题中数据可知,溶液中c(Fe2+)•c2(OH-)=1×10-6×(1×10-5.5)2=1×10-17<Ksp[Fe(OH)2]=4.9×10-17,故无Fe(OH)2沉淀生成,
故答案为:否;液中c(Fe2+)•c(OH-)2=1×10-6×(1×10-5.5)2=1×10-17<Ksp[Fe(OH)2]=4.9×10-17,故无Fe(OH)2沉淀生成;
(7)根据题意,最后称得残留固体bg为氧化铁,则铁元素的质量为$\frac{112}{160}$×bg=0.7bg,根据铁元素守恒可知样品中铁元素的质量为0.7bg,所以样品中Fe元素的质量分数为$\frac{0.7bg}{ag}$×100%=$\frac{70b}{a}$%,故答案为:$\frac{70b}{a}$%.
点评 本题考查物质的制备实验,为高频考点,把握制备流程、物质的性质、发生的反应为解答的关键,侧重分析与实验、计算能力的综合考查,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | H2SO4是酸,因为H2SO4中含有氢元素 | |
| B. | 豆浆是胶体,因为豆浆中的分散质粒子直径在1~100 nm之间 | |
| C. | Na在Cl2中燃烧属于氧化还原反应,因为反应中有电子得失 | |
| D. | Na和H2O的反应不是离子反应,因为反应中没有离子参加 |
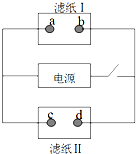 如图中滤纸Ⅰ上浸有饱和食盐水和酚酞,滤纸Ⅱ上浸有KMnO4溶液,接通电源一段时间后,发现a点附近变红,则下列说法中正确的是( )
如图中滤纸Ⅰ上浸有饱和食盐水和酚酞,滤纸Ⅱ上浸有KMnO4溶液,接通电源一段时间后,发现a点附近变红,则下列说法中正确的是( )| A. | a点和电源正极相连 | B. | b点发生还原反应 | ||
| C. | c点附近pH减小 | D. | d点附近颜色加深 |
①该电池负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O;
②若以该电池为电源,用石墨做电极电解200mL含有如下离子的溶液.
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 0.5 | 2 | 2 | 0.5 |
| A. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| B. | 苯能使溴水褪色,是因为苯与溴发生了化学反应 | |
| C. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成3 mol H2O | |
| D. | 光照下2,2二甲基丙烷与Br2反应,其一溴取代物只有一种 |
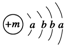 ,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.
,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子. .
.