题目内容
下列各组离子在溶液中既可以大量共存,且加入氢氧化钠溶液后也不产生沉淀的是( )
| A、Na+、Ba2+、Cl-、SO42- |
| B、K+、Na+、NO3-、OH- |
| C、H+、NH4+、Fe3+、SO42- |
| D、H+、Cl-、CH3COO-、NO3- |
考点:离子共存问题
专题:
分析:根据离子之间不能结合生成沉淀、气体、水、弱电解质等,则离子大量共存,并结合加入氢氧化钠溶液后也不产生沉淀来解答.
解答:
解:A.Ba2+、SO42-结合生成沉淀,不能大量共存,故A错误;
B.该组离子之间不反应,可大量共存,且加入氢氧化钠溶液后也不产生沉淀,故B正确;
C.该组离子之间不反应,可大量共存,但加入NaOH溶液与Fe3+结合生成沉淀,故C错误;
D.H+、CH3COO-结合生成弱电解质,不能大量共存,故D错误;
故选B.
B.该组离子之间不反应,可大量共存,且加入氢氧化钠溶液后也不产生沉淀,故B正确;
C.该组离子之间不反应,可大量共存,但加入NaOH溶液与Fe3+结合生成沉淀,故C错误;
D.H+、CH3COO-结合生成弱电解质,不能大量共存,故D错误;
故选B.
点评:本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,题目难度不大.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案
相关题目
在25℃时,某溶液中由水电离出的c(H+)=1.0×10-12mol/L,则该溶液中可能大量共存的离子是( )
| A、Na+、OH-、S2-、NO3- |
| B、AlO2-、K+、Fe3+、Na+ |
| C、Al3+、Cl-、HCO3-、Na+ |
| D、Fe2+、K+、Cl-、NO3- |
某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:下列推断合理的是( )


| A、甲为CO2;乙为NH3 |
| B、由滤液提纯(NH4)2SO4过程中的实验操作为萃取 |
| C、CO2可被循环使用 |
| D、上述过程中涉及到的反应全部是氧化还原反应 |
下列各组物质,属于电解质是( )
| A、NaCl晶体 | B、铜 |
| C、酒精 | D、硫酸溶液 |
下列反应类型中,一定没有发生电子转移的是( )
| A、复分解反应 | B、置换反应 |
| C、分解反应 | D、化合反应 |
下列图示与对应叙述相符合的是( )
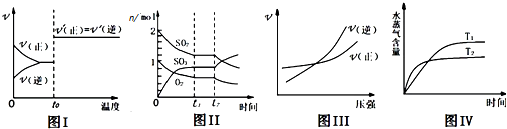

| A、图I:反应CO+NO2═CO2+NO达平衡后,升高温度时反应速率随时间的变化 |
| B、图Ⅱ:反应2SO2+O2═2SO3 达平衡后,缩小容器体积时各成分的物质的量随时间的变化 |
| C、图Ⅲ:反应N2+3H2═2NH3在恒温情况下,反应速率与压强的关系 |
| D、图Ⅳ:反应CO2(g)+H2(g)═CO(g)+H2O(g)△H>0,水蒸气含量随时间的变化 |