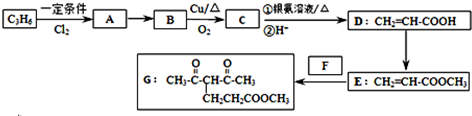
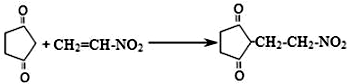
题目内容
几种可燃物的燃烧热△H如表所示:
工业上,在高温下利用CH4与CO2反应制备合成气CO与H2,则反应:CH4(g)+CO2(g)═2CO(g)+2H2(g)△H等于( )
| 物质 | CH4 | CH3OH(l) | CH3CH2OH(l) | CO(g) | H2(g) |
| 燃烧热△H/kJ?mol-1 | -890.31 | -726.51 | -1366.8 | -283 | -285.8 |
| A、-247.3kJ?mol-1 |
| B、+247.3kJ?mol-1 |
| C、+321.5kJ?mol-1 |
| D、-321.5kJ?mol-1 |
考点:用盖斯定律进行有关反应热的计算
专题:
分析:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.31kJ/mol①、
CO(g)+
O2(g)=CO2(g)△H=-283kJ/mol②、
H2(g)+
O2(g)=H2O(l)△H=-285.8kJ/mol ③,
根据盖斯定律计算CH4(g)+CO2(g)═2CO(g)+2H2(g)的△H.
CO(g)+
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
根据盖斯定律计算CH4(g)+CO2(g)═2CO(g)+2H2(g)的△H.
解答:
解:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.31kJ/mol①、
CO(g)+
O2(g)=CO2(g)△H=-283kJ/mol②、
H2(g)+
O2(g)=H2O(l)△H=-285.8kJ/mol ③,
将方程式①-2(②+③)得CH4(g)+CO2(g)═2CO(g)+2H2(g),△H=-890.31kJ/mol-2×(-283kJ/mol-285.8kJ/mol )=+247.3kJ?mol-1,
故选B.
CO(g)+
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
将方程式①-2(②+③)得CH4(g)+CO2(g)═2CO(g)+2H2(g),△H=-890.31kJ/mol-2×(-283kJ/mol-285.8kJ/mol )=+247.3kJ?mol-1,
故选B.
点评:本题考查盖斯定律,侧重考查计算能力,根据目标方程式结合已知方程式利用盖斯定律计算即可,注意焓变与计量数成正比.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
已知在酸性溶液中的还原性强弱顺序为:SO2>I->H2O2>Fe2+>Cl-,下列反应不可能发生的是( )
| A、H2O2+H2SO4=SO2↑+O2↑+2 H2O |
| B、2I-+2Fe3+=I2+2 Fe2+ |
| C、2Fe3++SO2+2 H2O=2Fe2++SO42-+4H+ |
| D、SO2+2 H2O+I2=H2SO4+2HI |
下列有关实验的叙述,正确的是( )
| A、用量筒量取5.00mL 1.00mol?L-1盐酸于50mL容量瓶中,加水稀释至刻度可配制0.100mol?L-1盐酸 |
| B、用10mL的量筒准确量取9.50mL水 |
| C、向碘水中加入CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘 |
| D、稀释浓硫酸时将水倒入浓硫酸中进行搅拌 |
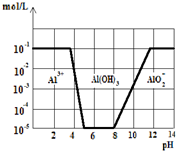 常温下,在0.1mol?L-1KAl(SO4)2溶液中,加入KOH固体,如图,横坐标
常温下,在0.1mol?L-1KAl(SO4)2溶液中,加入KOH固体,如图,横坐标为溶液的pH,纵坐标为Al3+离子或AlO2-离子的物质的量浓度.(假设Al3+
离子浓度为10-5mol?L-1时,Al3+离子已沉淀完全),下列说法不正确的是( )
| A、从图中数据计算可得Al(OH)3的溶度积Ksp=10-23 |
| B、沉淀Al3+可以控制溶液pH的范围为5~8 |
| C、向KAl(SO4)2溶液中加入KOH固体至pH=7时,c(K+):c(SO42-)=2:1 |
| D、往KAl(SO4)2溶液中加入足量的氢氧化钾溶液,反应的离子方程式可表示为:Al3++4OH-=AlO2-+2H2O |
下列与有机物相关的说法错误的是( )
| A、用溴水可以鉴别乙醇、苯和四氯化碳 |
| B、乙酸乙酯中的少量乙酸可以用氢氧化钠溶液除去 |
| C、用新制氢氧化铜悬浊液可以检验尿液中是否含有葡萄糖 |
| D、用酸性高锰酸钾溶液可以区分乙烷和乙烯 |


 分别表示N2、H2、NH3.
分别表示N2、H2、NH3.