题目内容
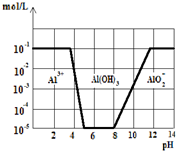 常温下,在0.1mol?L-1KAl(SO4)2溶液中,加入KOH固体,如图,横坐标
常温下,在0.1mol?L-1KAl(SO4)2溶液中,加入KOH固体,如图,横坐标为溶液的pH,纵坐标为Al3+离子或AlO2-离子的物质的量浓度.(假设Al3+
离子浓度为10-5mol?L-1时,Al3+离子已沉淀完全),下列说法不正确的是( )
| A、从图中数据计算可得Al(OH)3的溶度积Ksp=10-23 |
| B、沉淀Al3+可以控制溶液pH的范围为5~8 |
| C、向KAl(SO4)2溶液中加入KOH固体至pH=7时,c(K+):c(SO42-)=2:1 |
| D、往KAl(SO4)2溶液中加入足量的氢氧化钾溶液,反应的离子方程式可表示为:Al3++4OH-=AlO2-+2H2O |
考点:离子方程式的有关计算,难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:A.计算溶度积需知道氢氧化铝沉淀溶解平衡中铝离子浓度和氢氧根离子浓度,带入溶度积表达式计算;
B.从图象分析pH的控制范围;
C.根据电荷守恒分析;
D.铝离子和过量碱反应生成偏铝酸根离子和水.
B.从图象分析pH的控制范围;
C.根据电荷守恒分析;
D.铝离子和过量碱反应生成偏铝酸根离子和水.
解答:
解:A.计算溶度积需知道氢氧化铝沉淀溶解平衡中铝离子浓度和氢氧根离子浓度,从图象知道当铝离子沉淀完全时,pH=5,铝离子沉淀完全,Ksp=c(Al3+)?c3(OH-)=10-5×(10-5)3=10-20,故A错误;
B.从图象可知,pH=5沉淀完全,pH=8沉淀开始溶解,故沉淀Al3+可以控制溶液pH的范围为5~8,故B正确;
C.从图象可知,pH=7时,铝离子沉淀完全,根据电荷守恒,c(H+)+(K+)=C(OH-)+2c(SO42-),因pH=7,则c(H+)=C(OH-),所以:c(K+):c(SO42-)=2:1,故C正确;
D.铝离子和过量碱反应生成偏铝酸根离子和水,反应的离子方程式为:Al3++4OH-=AlO2-+2H2O,故D正确;
故选A.
B.从图象可知,pH=5沉淀完全,pH=8沉淀开始溶解,故沉淀Al3+可以控制溶液pH的范围为5~8,故B正确;
C.从图象可知,pH=7时,铝离子沉淀完全,根据电荷守恒,c(H+)+(K+)=C(OH-)+2c(SO42-),因pH=7,则c(H+)=C(OH-),所以:c(K+):c(SO42-)=2:1,故C正确;
D.铝离子和过量碱反应生成偏铝酸根离子和水,反应的离子方程式为:Al3++4OH-=AlO2-+2H2O,故D正确;
故选A.
点评:本题考查了硫酸铝钾和氢氧化钾反应的计算,中等难度,注意分析图象数据和氢氧化铝的两性.

练习册系列答案
相关题目
几种可燃物的燃烧热△H如表所示:
工业上,在高温下利用CH4与CO2反应制备合成气CO与H2,则反应:CH4(g)+CO2(g)═2CO(g)+2H2(g)△H等于( )
| 物质 | CH4 | CH3OH(l) | CH3CH2OH(l) | CO(g) | H2(g) |
| 燃烧热△H/kJ?mol-1 | -890.31 | -726.51 | -1366.8 | -283 | -285.8 |
| A、-247.3kJ?mol-1 |
| B、+247.3kJ?mol-1 |
| C、+321.5kJ?mol-1 |
| D、-321.5kJ?mol-1 |
和水杨酸(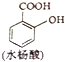 )分子式相同,并且分子中含有6个碳原子在一条直线上,分子中所有官能团包括水杨酸具有的含氧官能团的有机物是( )
)分子式相同,并且分子中含有6个碳原子在一条直线上,分子中所有官能团包括水杨酸具有的含氧官能团的有机物是( )
 )分子式相同,并且分子中含有6个碳原子在一条直线上,分子中所有官能团包括水杨酸具有的含氧官能团的有机物是( )
)分子式相同,并且分子中含有6个碳原子在一条直线上,分子中所有官能团包括水杨酸具有的含氧官能团的有机物是( )| A、2种 | B、3种 | C、4种 | D、5种 |
常温下,将pH=3的盐酸和pH=11的氨水等体积混合后,溶液中离子浓度关系是 ,而常温下,1mol?L-1的CH3COOH溶液与1mol?L-1的NaOH溶液等体积混合后,所得溶液中离子浓度关系是 .
在配制500ml 0.1mol/L的H2SO4溶液时,下列操作中会导致结果偏高的是( )
| A、洗净的容量瓶未经干燥就用于配制溶液 |
| B、未等溶液降至室温就转移至容量瓶 |
| C、转移溶液时不慎洒到容量瓶外 |
| D、定容时仰视刻度线 |
常温下,下列各组离子在指定的溶液中能大量共存的是( )
| A、滴入酚酞显红色的溶液:Na+、Al3+、SO42-、Cl- | ||
| B、滴入KSCN显红色的溶液:Na+、Cu2+、Br-、SO42- | ||
C、
| ||
D、c(H+)=
|
已知A、B、C、D四种物质中均含同种元素,且它们之间的转化关系如图.下列说法正确的是( )


| A、A一定为单质 |
| B、C一定为氧化物 |
| C、D一定为酸 |
| D、A、B、C的相对分子质量之差为16或16的倍数 |