题目内容
3.已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入NaIO3溶液.加入NaIO3的物质的量和析出的I2的物质的量的关系曲线如图(不考虑I2+I-?I3-)下列说法不正确的是( )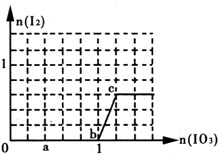
| A. | a点时消耗NaHSO3的物质的量为1.2 mol,得到的氧化产物为SO42- | |
| B. | b~c段的反应可用如下离子方程式表示:IO3-+5 I-+6H+═3I2+3H2O | |
| C. | 滴加过程中水的电离平衡一直逆向移动 | |
| D. | 从c点后所得混合液中分离出碘的操作为:加四氯化碳萃取分液,然后蒸馏 |
分析 A、a点碘酸钾的物质的量是0.4mol,发生以下反应离子方程式:IO3-+3HSO3-═I-+3SO42-+3H+,则消耗NaHSO3的物质的量=$\frac{0.4mol}{1}$×3=1.2mol;
B、由图可知,b点到c点有碘生成,应发生IO3-+6H++5I-=3H2O+3I2;
C、当碘酸钠过量时,碘酸根离子的水解对水的电离起促进作用;
D、应用相似相溶的原理分析解答.
解答 解:A、a点碘酸钾的物质的量是0.4mol,发生以下反应离子方程式:IO3-+3HSO3-═I-+3SO42-+3H+,则消耗NaHSO3的物质的量=$\frac{0.4mol}{1}$×3=1.2mol,所以氧化产物为硫酸根离子,故A正确;
B、由图可知,b点到c点由于生成I2,故发生反应:IO3-+6H++5I-=3H2O+3I2,故B正确;
C、当碘酸钠过量时,碘酸根离子的水解对水的电离起促进作用,所以当c点后电离平衡正向移动,故C错误;
D、应用相似相溶,碘单质易溶于四氯化碳,所以加四氯化碳萃取分液,然后蒸馏,故D正确;
故选C.
点评 本题是一道有关氧化还原反应的综合题,考查角度广,难度中等,要求学生具有分析和解决问题的能力.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
16.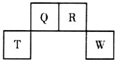 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中W的原子核内质子数与核外最外层电子数之比为8:3.下列说法正确的是( )
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中W的原子核内质子数与核外最外层电子数之比为8:3.下列说法正确的是( )
 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中W的原子核内质子数与核外最外层电子数之比为8:3.下列说法正确的是( )
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中W的原子核内质子数与核外最外层电子数之比为8:3.下列说法正确的是( )| A. | Q与W的原子能形成非极性分子 | |
| B. | T的离子半径大于W的离子半径 | |
| C. | RHn在同族元素的气态氢化物中沸点最低 | |
| D. | 在R的最高价氧化物对应水化物的浓溶液中单质T不溶解,说明未发生化学反应 |
14.在炼铜的过程中发生:Cu2S+2Cu2O═6Cu+SO2↑,则下列叙述正确的是( )
| A. | 该反应从电子转移角度看,与SO2+H2O═H2SO3是同一反应类型 | |
| B. | 该反应从电子转移角度看,每生成6mol铜,转移电子12mol | |
| C. | 该反应中,Cu2S既是还原剂又是氧化剂 | |
| D. | 该反应中,氧元素氧化了硫元素 |
11.下列选项正确的是( )
| A. | 汽车催化转化器中尾气处理反应的化学方程式为CO+NO$\frac{\underline{\;\;△\;\;}}{\;}$C+NO2 | |
| B. | 铁红溶于足量氢碘酸的离子方程式为Fe2O3+6H+═2Fe3++3H2O | |
| C. | 加入铝粉能产生氢气的溶液中可能存在大量的:K+、Ba2+、AlO2-、Cl- | |
| D. | pH=0的溶液中可能存在大量的:Na+、Fe2+、SO42-、ClO- |
18.如表实验中,对应的现象和结论都正确,且两者具有因果关系的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 将少量碳酸钙粉末加入到饱和NH4Cl溶液中 | 产生气体,粉末溶解 | NH4Cl水解使溶液呈酸性 |
| B | 将BaSO4固体粉末加入饱和Na2CO3溶液中,搅拌,过滤,洗涤,在滤渣中加入稀盐酸 | 产生气体,滤渣部分溶解 | Ksp(BaCO3)<Ksp(BaSO4) |
| C | 将黑色氧化铜粉末进行高温加热 | 黑色变成红色 | CuO分解生成铜单质 |
| D | 将某溶液滴加过量的稀盐酸 | 有刺激性气味气体产生,溶液中出现沉淀 | 溶液中一定存在S2-和SO32- |
| A. | A | B. | B | C. | C | D. | D |
8.下列叙述错误的是( )
| A. | 淀粉、油脂、蛋白质在一定条件下都可以发生水解反应 | |
| B. | 溴苯分子中苯环上的一个氢原子被-C4H9原子团取代形成的同分异构体共有12种 | |
| C. | 乙醇、乙酸、乙酸乙酯都能发生取代反应 | |
| D. | 乙烯、甲烷都不能使溴的四氯化碳溶液和酸性KmnO4溶液褪色 |
15.下表中“试剂”与“操作及现象”对应关系错误的是( )
| 选项 | 试剂 | 操作及现象 |
| A | AgNO3溶液 | 滴加氨水,产生沉淀;继续滴加氨水,沉淀溶解 |
| B | 铝粉 | 滴加NaOH溶液,产生气体;继续滴加,产生白色沉淀 |
| C | CuSO4溶液 | 加过量NaOH溶液,产生蓝色沉淀;再加乙醛,加热,产生红色沉淀 |
| D | 氯水 | 滴加NaOH溶液,溶液颜色褪去;再加HCl,溶液颜色恢复 |
| A. | A | B. | B | C. | C | D. | D |
12.某消毒液的主要成分为NaClO,下列有关该混合溶液的叙述正确的是( )
| A. | 该溶液中,H+、NH4+、SO42-、Br-可以大量共存 | |
| B. | 该溶液中,Ag+、K+、NO3-、CH3CHO可以大量共存 | |
| C. | 向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023个 | |
| D. | 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+═Cl-+2Fe3++H2O |
10.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 无色透明的溶液中:Na+、MnO4-、NO3-、Br- | |
| B. | 0.1 mol•L-1CaCl2溶液中:Mg2+、NH4+、CO32-、SO42- | |
| C. | Kw/c(OH-)=10-12 mol•L-1的溶液:Na+、K+、SiO32-、Cl- | |
| D. | 水电离产生的c(H+)=10-12 mol•L-1的溶液中:K+、Fe2+、NO3-、Cl- |