题目内容
14.如图所示是一个电化学装置的示意图.
请回答下列问题:
(1)图中甲池是原电池(填“原电池”、“电解池”或“电镀池”).
(2)A(石墨)电极的名称是阳极(填“正极”、“负极”、“阴极”或“阳极”).
(3)写出通入CH3OH的电极的电极反应式:CH3OH-6e-+8OH-═6H2O+CO32-.
(4)乙池中反应的化学方程式为4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3.
(5)当乙池中B(Ag)极质量增加5.4g时,甲池中理论上消耗O2的体积为0.28L(标准状况),此时丙池中某电极析出1.6g某金属,则丙池中的某盐溶液可能是B(填字母).
A. MgSO4 B.CuSO4 C. NaCl D. AgNO3.
分析 (1)图中甲池能自发进行氧化还原反应,属于原电池,通燃料的电极是负极,通氧气的电极是正极;
(2)通入甲醇的电极为负极、通入氧气的电极为正极,电解池中连接原电池负极的电极为阴极、连接原电池正极的电极为阳极;
(3)甲醇失电子和氢氧根离子反应生成碳酸根离子和水;
(4)乙池中A电极上氢氧根离子放电、阴极上银离子放电,据此书写乙池中反应的化学方程式;
(5)根据转移电子相等结合电极反应式进行计算.
解答 解:(1)图中甲池能自发进行氧化还原反应,将化学能转化为电能,属于原电池,故答案为:原电池;
(2)通入甲醇的电极为负极、通入氧气的电极为正极,A连接原电池正极,为电解池阳极,故答案为:阳极;
(3)甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3OH-6e-+8OH-═6H2O+CO32-,故答案为:CH3OH-6e-+8OH-═6H2O+CO32-;
(4)乙池中A电极上氢氧根离子放电、阴极上银离子放电,所以乙池电池反应式为4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3,
故答案为:4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3;
(5)B(Ag)极的质量增加5.4g时,n(Ag)=$\frac{5.4g}{108g/mol}$=0.05mol,则转移电子为0.05mol,根据转移电子相等,甲池中理论上消耗O2的体积=$\frac{0.05mool}{4}$×22.4L/mol=0.28L,此时丙池中某电极析出1.6g某金属,转移电子为0.05mol,所以金属的摩尔质量是64g/mol,所以电解质是含有铜离子的盐溶液,故选B.
故答案为:0.28;B.
点评 本题考查了原电池和电解池原理,为高频考点,涉及电极反应式的书写及物质的量的金属,会结合电解质溶液酸碱性书写电极反应式,再结合转移电子相等进行计算,题目难度不大.

 名校课堂系列答案
名校课堂系列答案| A. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| B. | “丹砂(HgS)烧之成水银,积变又还成了丹砂”,该过程发生了分解、化合、氧化还原反应 | |
| C. | 干燥剂硅胶和硅橡胶的主要化学成分都是二氧化硅 | |
| D. | 铜制品在潮湿的空气中生锈,其主要原因是发生了析氢腐蚀 |
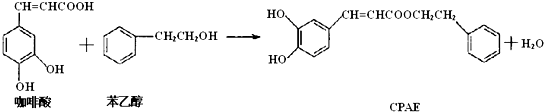
下列说法不正确的是( )
| A. | 咖啡酸分子中所有原子不可能处在同一个平面上 | |
| B. | 可用金属Na检测上述反应是否残留苯乙醇 | |
| C. | 1mol 苯乙醇在O2中完全燃烧,需消耗10molO2 | |
| D. | 1mol CPAE与足量的NaOH溶液反应,最多消耗3molNaOH |
| A. | a>b>c>d | B. | a>c>d>b | C. | c>a>b>d | D. | b>d>c>a |
| 已知条件 | 热化学方程式 | |
| A | CH4的燃烧热(△H)为-890kJ• mol-1 | CH4(g)+2O2(g)═CO2(g)+2H2O(g) △H=-890kJ• mol-1 |
| B | 中和热△H=-57.3kJ•mol-1 | CH3COOH(aq)+NaOH(aq)═H2O+CH3COONa (aq)△H=-57.3kJ•mol-1 |
| C | 一定条件下,0.5mol N2与1.5mol H2充分反应后放出30.5kJ的热量 | N2(g)+3H2(g)?2NH3(g)△H=-61kJ•mol-1 |
| D | 96g O2的能量比96g O3的能量低bkJ | 3O2(g)?2O3(g)△H=+bkJ• mol-1 |
| A. | A | B. | B | C. | C | D. | D |
| A. | Al--Al2O3--Al(OH)3--Na[Al(OH)4] | B. | Mg--MgCl2--Mg(OH)2--MgO | ||
| C. | S--SO3--H2SO4--MgSO4 | D. | Si--SiO2--H2SiO3--Na2SiO3 |
