题目内容
19.某混合气体由碳原子数相同的烷烃、烯烃、炔烃中的两种气体组成.将1.0L混合气体在02中完全燃烧生成3.0LCO2和3.7L水蒸气(气体体积在相同条件下测定).试判断混合气体的成分并求两类烃的体积比.分析 将1.0L混合气体在02中完全燃烧生成3.0LCO2和3.7L水蒸气,可知$\frac{n(H)}{n(C)}$=$\frac{3.7×2}{3.0}$=2.5>2,则一定含有烷烃,有机物平均分子式为C3H7.4,以此解答该题.
解答 解:将1.0L混合气体在02中完全燃烧生成3.0LCO2和3.7L水蒸气,可知$\frac{n(H)}{n(C)}$=$\frac{3.7×2}{3.0}$=2.5>2,则一定含有烷烃,有机物平均分子式为C3H7.4,
设烷烃为xmol,另一种烃为(1-x)mol,
C原子数都为3,则为C3H8与C3H4或C3H6的混合物,则8x+(1-x)×4=7.4或8x+(1-x)×6=7.4,x=0.85或0.3,则比值分别为17:3或3:7;
答:混合气体为C3H8与C3H4或C3H6的混合物,比值分别为17:3或3:7.
点评 本题考查混合物的计算,侧重于学生的分析、计算能力的考查,题目难度中等,注意把握有机物分子组成的特点,难度中等.

练习册系列答案
相关题目
9.短周期元素X、Y、Z、W、U原子序数依次增大.X与W位于同一主族,Y、Z形成的氧化物均是常见的耐火材料,W原子的最外层电子数是次外层电子数的一半,Z、W、U原子的最外层电子数之和为13.下列说法正确的是( )
| A. | X、W、U的最高价氧化物对应的水化物酸性由强到弱的顺序为:U>W>X | |
| B. | Y、Z元素的单质作电极,在氢氧化钠溶液中构成原电池,Z电极上产生大量气泡 | |
| C. | 室温下,0.05.mol•L-1U的气态氢化物的水溶液的pH>1 | |
| D. | Y、Z、U元素的简单离子半径由大到小的顺序:Y>Z>U |
10.亚硝酸钠(有毒性,市场上很易与食盐混淆)是一种常见的工业用盐,广泛用于物质合成、金属表面处理等,物理性质与NaCl极为相似.相关化学性质如图所示,下列说法不正确的是( )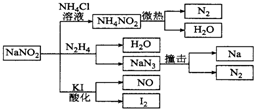

| A. | 实验室可用NaNO2和NH4Cl溶液混合加热制取氮气 | |
| B. | NaNO2与N2H4反应中,NaNO2是氧化剂 | |
| C. | 可用KI-淀粉试纸和食醋鉴别NaNO2和NaCl | |
| D. | 分解NaN3盐每产生1 mol N2转移6 mole一 |
11.在一定温度下的定容密闭容器中,当物质的下列物理量不再变化时.表明反应:A(g)+B(g)?C(g)+D(g)已达平衡的是( )
| A. | 混合气体的压强 | B. | 混合气体的密度 | ||
| C. | B的物质的量浓度 | D. | 气体的总物质的量 |
5.下列物质的电子式书写正确的是( )
| A. |  | B. |  | C. |  | D. |  |

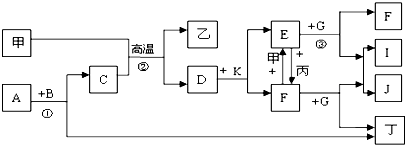
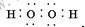 、甲在周期表中位置是第四周期第Ⅷ族;
、甲在周期表中位置是第四周期第Ⅷ族;