题目内容
二甲醚是一种重要的清洁燃料.合成二甲醚是解决能源危机的研究方向之一.
(1)用CO2和H2可以合成二甲醚(CH3OCH3)
已知:CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ?mol-1
2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ?mol-1
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ?mol-1
则反应2CO2(g)+6H2(g)→CH3OC3(g)+3H2O(g)的△H=
(2)已知在一定温度下,以下三个反应的平衡常数为K1、K2、K3:
C(s)+CO2(g)?2CO(g) K1
CO(g)+H2O(g)?CO2(g)+H2(g) K2
C(s)+H2O(g)?CO(g)+H2(g) K3
则K1、K2、K3之间的关系是
(3)二甲醚(CH3OCH3)燃料电池可以提升能量利用率.利用二甲醚酸性介质燃料电池电解100mL 1mo1?L-1的食盐水(惰性电极),电解一段时间后,收集到标况下的氢气2.24L(设电解后溶液体积不变)
①二甲醚燃料电池的负极反应式为 .
②电解后溶液的pH=
(4)工业合成氨的反应为:N2(g)+3H2 (g)?2NH3 (g)△H=-92.4kJmol-1
已知合成氨反应在某温度下2L的密闭绝热容器中进行,测得数据如下表:
根据表中数据计算:
①0min~1min内N2的平均反应速率为
②该条件下反应的平衡常数K= (保留两位小数)
③反应达到平衡后,若往平衡体系中再加入N2、H2、NH3各1mol,
化学平衡向 (填“正向”、“逆向”或“不移动”),该反应的平衡常数K (填“变大”“减小”或“不变”)
(5)常温下,将0.2mol?L-1HCOOH和0.1mol?L-1NaOH溶液等体积混合,所得溶液的pH<7,说明HCOOH的电离程度 HCOONa的水解程度(填“大于”或“小于”).该溶液中[HCOOH]-[OH-]+[H+]= mol?L-1.
(1)用CO2和H2可以合成二甲醚(CH3OCH3)
已知:CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ?mol-1
2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ?mol-1
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ?mol-1
则反应2CO2(g)+6H2(g)→CH3OC3(g)+3H2O(g)的△H=
(2)已知在一定温度下,以下三个反应的平衡常数为K1、K2、K3:
C(s)+CO2(g)?2CO(g) K1
CO(g)+H2O(g)?CO2(g)+H2(g) K2
C(s)+H2O(g)?CO(g)+H2(g) K3
则K1、K2、K3之间的关系是
(3)二甲醚(CH3OCH3)燃料电池可以提升能量利用率.利用二甲醚酸性介质燃料电池电解100mL 1mo1?L-1的食盐水(惰性电极),电解一段时间后,收集到标况下的氢气2.24L(设电解后溶液体积不变)
①二甲醚燃料电池的负极反应式为
②电解后溶液的pH=
(4)工业合成氨的反应为:N2(g)+3H2 (g)?2NH3 (g)△H=-92.4kJmol-1
已知合成氨反应在某温度下2L的密闭绝热容器中进行,测得数据如下表:
| 不同时间各物质的物质的量/mol | |||||
| 0min | 1min | 2min | 3min | 4min | |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
①0min~1min内N2的平均反应速率为
②该条件下反应的平衡常数K=
③反应达到平衡后,若往平衡体系中再加入N2、H2、NH3各1mol,
化学平衡向
(5)常温下,将0.2mol?L-1HCOOH和0.1mol?L-1NaOH溶液等体积混合,所得溶液的pH<7,说明HCOOH的电离程度
考点:热化学方程式,原电池和电解池的工作原理,化学平衡的影响因素,化学平衡的计算
专题:
分析:(1)首先写出反应的化学方程式,即2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g),然后利用盖斯定律解题;
(2)根据平衡常数的表达式推断;
(3)①原电池负极发生氧化反应,二甲醚在负极放电,酸性条件下生成二氧化碳碳,据此解答即可;
②根据电解氯化钠溶液的电解方程式来求溶液的pH;
(4)根据化学平衡三段式列式计算即可;
(5)根据混合溶液的酸碱性判断,依据电中性原则以及侄子守恒计算.
(2)根据平衡常数的表达式推断;
(3)①原电池负极发生氧化反应,二甲醚在负极放电,酸性条件下生成二氧化碳碳,据此解答即可;
②根据电解氯化钠溶液的电解方程式来求溶液的pH;
(4)根据化学平衡三段式列式计算即可;
(5)根据混合溶液的酸碱性判断,依据电中性原则以及侄子守恒计算.
解答:
解:(1)利用盖斯定律进行计算,将三个方程式进行形式变换,
2CO(g)+4H2(g)=2CH3OH(g)△H=-181.4 kJ?mol-1
2CH3OH(g=CH3OCH3(g)+H2O(g)△H=-23.5 kJ?mol-1
2CO2(g)+2H2(g)=2CO(g)+2H2O(g)△H=+82.4 kJ?mol-1
三式相加得:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g)△H=-122.5 kJ?mol-1,故答案:-122.5 kJ?mol-1;
(2)根据化学方程式可知:K1=
,K2=
,K3=
,所以:K3=K1×K2;故答案为:K3=K1?K2;
(3)①原电池负极发生氧化反应,二甲醚在负极放电,酸性条件下生成二氧化碳,电极反应式为:CH3OCH3-12e-+3H2O=2CO2+12H+;故答案为:CH3OCH3-12e-+3H2O=2CO2+12H+;
②由方程式:2NaCl+2H2O
2NaOH+H2↑+Cl2↑
2 2 22.4
10-3
×100mL×1mol/L 0.1 2.24L
由题可知:之后反应为直接电解水,溶液pH值不改变,c(H+)=
=10-14,所以pH=14,故答案为14;
(4)①反应1min内,反应速率v(N2)=
=0.15mol?L-1?min-1,故0min~1min内N2的平均反应速率为:0.15÷3=0.05mol/(L?min),故答案为:0.05mol?L-1?min-1;
②已知合成氨反应,3min成氨气1mol,则
N2(g)+3H2(g)?2NH3(g)
起始量(mol) 1.5 4.5 0
变化量(mol) 0.5 1.5 1
平衡量(mol) 1 3 1
此温度下,平衡浓度为c(N2)=0.5mol/L,c(H2)=1.5mol/L,c(NH3)=0.5mol/L,该反应的平衡常数K=
=
≈O.015,故答案为:0.15;
③反应达到平衡后,若维持容器体积不变,温度不变,往平衡体系中加入H2、N2和NH3各1mol,则此时各物质的浓度为:N2为0.5mol/L+0.5mol/L=1mol/L,H2为1.5mol/L+0.5mol/L=2mol/L,NH3为0.5mol/L+0.5mol/L=1mol/L,故浓度商Qc=
<0.15,故反应向正反应进行,平衡常数只与温度有关,该反应为放热反应,处于绝热容器中,温度升高,故平衡常数减小,故答案为:正向;减小;
(5)酸的物质的量是碱的物质的量的2倍,且酸碱都是一元的,反应后生成等物质的量的HCOOH和HCOONa;如果酸电离的程度大于盐水解的程度,溶液呈酸性,pH<7,故电离大于水解,此溶液中存在:c(Na+)+c(H+)=c(HCOO-)+c(OH-)①,c(HCOO-)+c(HCOOH)=2(Na+)=0.1mol/L②,故联立①②得出:[HCOOH]-[OH-]+[H+]=0.05,故答案为:大于;0.05.
2CO(g)+4H2(g)=2CH3OH(g)△H=-181.4 kJ?mol-1
2CH3OH(g=CH3OCH3(g)+H2O(g)△H=-23.5 kJ?mol-1
2CO2(g)+2H2(g)=2CO(g)+2H2O(g)△H=+82.4 kJ?mol-1
三式相加得:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g)△H=-122.5 kJ?mol-1,故答案:-122.5 kJ?mol-1;
(2)根据化学方程式可知:K1=
| c2(CO) |
| c(CO2) |
| c(H2)×c(CO2) |
| c(CO)×c(H2O) |
| c(CO)×c(H2) |
| c(H2O) |
(3)①原电池负极发生氧化反应,二甲醚在负极放电,酸性条件下生成二氧化碳,电极反应式为:CH3OCH3-12e-+3H2O=2CO2+12H+;故答案为:CH3OCH3-12e-+3H2O=2CO2+12H+;
②由方程式:2NaCl+2H2O
| ||
2 2 22.4
10-3
| L |
| mL |
由题可知:之后反应为直接电解水,溶液pH值不改变,c(H+)=
| 10-14 | ||
|
(4)①反应1min内,反应速率v(N2)=
| ||
| 1min |
②已知合成氨反应,3min成氨气1mol,则
N2(g)+3H2(g)?2NH3(g)
起始量(mol) 1.5 4.5 0
变化量(mol) 0.5 1.5 1
平衡量(mol) 1 3 1
此温度下,平衡浓度为c(N2)=0.5mol/L,c(H2)=1.5mol/L,c(NH3)=0.5mol/L,该反应的平衡常数K=
| c2(NH3) |
| c(N2)×c3(H2) |
| 0.52 |
| 0.5×1.53 |
③反应达到平衡后,若维持容器体积不变,温度不变,往平衡体系中加入H2、N2和NH3各1mol,则此时各物质的浓度为:N2为0.5mol/L+0.5mol/L=1mol/L,H2为1.5mol/L+0.5mol/L=2mol/L,NH3为0.5mol/L+0.5mol/L=1mol/L,故浓度商Qc=
| 12 |
| 1×23 |
(5)酸的物质的量是碱的物质的量的2倍,且酸碱都是一元的,反应后生成等物质的量的HCOOH和HCOONa;如果酸电离的程度大于盐水解的程度,溶液呈酸性,pH<7,故电离大于水解,此溶液中存在:c(Na+)+c(H+)=c(HCOO-)+c(OH-)①,c(HCOO-)+c(HCOOH)=2(Na+)=0.1mol/L②,故联立①②得出:[HCOOH]-[OH-]+[H+]=0.05,故答案为:大于;0.05.
点评:本题考查使用化石燃料的利弊及新能源的开发、用盖斯定律进行有关反应热的计算、盐类水解的应用,掌握离子浓度大小的比较是解题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
在2Fe2++Cl2=2Fe3++2Cl-反应中,关于生成1molFe3+的说法正确的是( )
| A、Fe2+失去电子的物质的量为2 mol |
| B、Cl2得电子的物质的量为1 mol |
| C、参加反应的Cl2的物质的量为1mol |
| D、氧化剂与还原剂的物质的量之比为1:1 |
下列电离方程式书写正确的是( )
| A、NaHCO3═Na++H++CO32- |
| B、Al2(SO4)3═2Al3++3SO42- |
| C、NaHS?Na++HS- |
| D、Ca(OH)2═Ca2++(OH)22- |
LED产品的使用为城市增添色彩.下图是氢氧燃料电池驱动LED发光的一种装置示意图.下列有关叙述正确的是( )
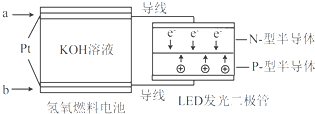

| A、a处通入O2 |
| B、b处为电池正极,发生了还原反应 |
| C、通入O2的电极发生反应:O2+4e-+4H+=2H2O |
| D、该装置将化学能最终转化为电能 |
在1L密闭容器中发生反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-Q kJ?mol-1(Q>O),容器内部分物质的物质的量浓度如下表:下列说法错误的是( )
| 时间/浓度 | c(NH3) (mol/L) | c(O2 ) (mol/L) | c(NO) (mol/L) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.7 | 1.475 | 0.1 |
| 第10min | 0.7 | 1.475 | 0.1 |
| A、反应在第2 min到第4min时,O2 的平均反应速率为0.1875 mol/(L?min) |
| B、反应在第2 min时改变了某一条件,该条件可能是使用催化剂或升高温度 |
| C、第4 min时、第8 min时分别达到化学平衡,且平衡常数相同 |
| D、在开始反应的前2 min内,该反应的放出0.05Q kJ的热量 |
下列有关实验装置正确的是( )
A、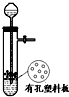 用于Cu和浓H2SO4反应制取少量的SO2气体 |
B、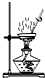 用于灼烧Al(OH)3 |
C、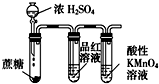 用于检验浓硫酸与蔗糖反应产生的二氧化硫 |
D、 由于实验室制备乙酸乙酯 |

 将一个装有饱和石灰水的试管放入盛有25℃饱和石灰水的广口瓶中,如图所示.
将一个装有饱和石灰水的试管放入盛有25℃饱和石灰水的广口瓶中,如图所示.