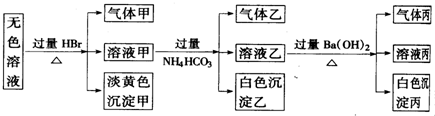
题目内容
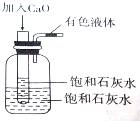 将一个装有饱和石灰水的试管放入盛有25℃饱和石灰水的广口瓶中,如图所示.
将一个装有饱和石灰水的试管放入盛有25℃饱和石灰水的广口瓶中,如图所示.向试管中逐渐加入氧化钙粉末.
(1)可以观察到的现象是:试管中
(2)试管中的固体是不是加入的CaO?
(3)广口瓶和导管中发生现象的原因是什么?
(4)反应前氧化钙和水的总能量与反应后石灰乳的总能量有怎样的关系?
考点:化学反应的能量变化规律,溶解度、饱和溶液的概念,吸热反应和放热反应
专题:
分析:氧化钙溶于水的反应是放热反应,且生成氢氧化钙,氢氧化钙的溶解度随着温度升高而降低,随着温度的降低而升高,据此解答各小题即可.
解答:
解:(1)氧化钙溶于水和水反应产生大量的热,该热量能使氢氧化钙的溶解度降低,所以试管中饱和石灰水中溶液变浑浊,氧化钙溶于水和水反应产生大量的热,该热量能使氢氧化钙的溶解度降低,故广口瓶中的饱和石灰水中溶液变浑浊,广口瓶这气体受热膨胀,导致瓶内压强增大,故导致导管中有颜色的液体右移,故答案为:溶液变浑浊;溶液变浑浊;有色液体右移;
(2)氧化钙溶于水,与水反应生成微溶的氢氧化钙,故该固体不是氧化钙,是氢氧化钙,故答案为:不是;
(3)氧化钙溶于水和水反应产生大量的热,该热量能使氢氧化钙的溶解度降低,所以饱和石灰水中溶液变浑浊,故答案为:该反应放热,温度升高,Ca(OH)2的溶解度变小而析出;
(4)氧化钙和水反应是一个放热反应,故反应前氧化钙和水的总能量大于反应后石灰乳的总能量,故答案为:反应前氧化钙和水的总能量大于反应后石灰乳的总能量.
(2)氧化钙溶于水,与水反应生成微溶的氢氧化钙,故该固体不是氧化钙,是氢氧化钙,故答案为:不是;
(3)氧化钙溶于水和水反应产生大量的热,该热量能使氢氧化钙的溶解度降低,所以饱和石灰水中溶液变浑浊,故答案为:该反应放热,温度升高,Ca(OH)2的溶解度变小而析出;
(4)氧化钙和水反应是一个放热反应,故反应前氧化钙和水的总能量大于反应后石灰乳的总能量,故答案为:反应前氧化钙和水的总能量大于反应后石灰乳的总能量.
点评:本题考查学生常见的放热反应和吸热反应以及氢氧化钙的溶解度随温度的变化关系,可以根据所学知识进行回答,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列有关金属腐蚀与保护的说法正确的是( )
| A、钢铁在潮湿空气中发生吸氧腐蚀,负极反应为Fe-3e-═Fe3+ |
| B、相同条件下,轮船在海水中比在淡水中腐蚀慢 |
| C、铁上镀锌的保护方法叫牺牲负极的正极保护法 |
| D、水库里钢闸门与电源负极相连的方法叫做外加电源的阴极保护法 |
 已知给煤炭加氢可发生反应:C(s)+2H2(g)?CH4(g).在VL的容器中投入amol碳(足量),同时通入2amolH2,控制条件使其发生上述反应,测得碳的平衡转化率随压强及温度的变化关系如下图所示.下列说法正确的是( )
已知给煤炭加氢可发生反应:C(s)+2H2(g)?CH4(g).在VL的容器中投入amol碳(足量),同时通入2amolH2,控制条件使其发生上述反应,测得碳的平衡转化率随压强及温度的变化关系如下图所示.下列说法正确的是( )| A、上述正反应为放热反应 | ||
| B、在4MPa、1200K时,图中X点v(H2)正>v(H2)逆 | ||
C、在5MPa、800K时,该反应的平衡常数为
| ||
| D、工业上维持6MPa1000K而不采用10MPa1000K,主要是因为前者碳的转化率高 |
下列有关说法正确的是( )
| A、钢铁的腐蚀过程中,析氢腐蚀与吸氧腐蚀不可能同时发生 |
| B、反应NH4Cl(s)=NH3(g)+HCl(g)在室温下不能自发进行,则该反应的△H>0 |
| C、由于Ksp(BaSO4)<Ksp(BaCO3),因此BaSO4沉淀不可能转化为BaCO3沉淀 |
| D、25℃时,0.1 mol?L-1CH3COOH溶液加水稀释后,c(OH-)/c(CH3COOH)增大 |