题目内容
LED产品的使用为城市增添色彩.下图是氢氧燃料电池驱动LED发光的一种装置示意图.下列有关叙述正确的是( )
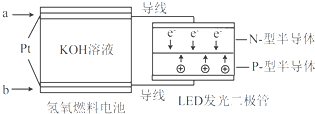

| A、a处通入O2 |
| B、b处为电池正极,发生了还原反应 |
| C、通入O2的电极发生反应:O2+4e-+4H+=2H2O |
| D、该装置将化学能最终转化为电能 |
考点:化学电源新型电池
专题:电化学专题
分析:A、由电子流向可知a为负极,b为正极,以此判断;
B、b为正极发生的电极反应为O2+2H2O+4e-═4OH-;
C、通氧气的一极为b极,b为正极发生的电极反应为O2+2H2O+4e-═4OH-;
D、该装置的能量转换有化学能、电能和光能等b.
B、b为正极发生的电极反应为O2+2H2O+4e-═4OH-;
C、通氧气的一极为b极,b为正极发生的电极反应为O2+2H2O+4e-═4OH-;
D、该装置的能量转换有化学能、电能和光能等b.
解答:
解:A、由电子流向可知a为负极,b为正极,负极上发生氧化反应,通入氢气,正极上发生还原反应,通入的是氧气,故A错误;
B、b为正极发生的电极反应为O2+2H2O+4e-═4OH-,发生还原反应,故B正确;
C、通氧气的一极为b极,b为正极发生的电极反应为O2+2H2O+4e-═4OH-,故C错误;
D、该装置的能量转换有化学能、电能和光能,故D错误.
故选B.
B、b为正极发生的电极反应为O2+2H2O+4e-═4OH-,发生还原反应,故B正确;
C、通氧气的一极为b极,b为正极发生的电极反应为O2+2H2O+4e-═4OH-,故C错误;
D、该装置的能量转换有化学能、电能和光能,故D错误.
故选B.
点评:本题考查原电池知识,题目难度不大,本题注意根据图示电子的流向判断电源的正负极为解答该题的关键.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
在一密闭容器中,可逆反应aA(g)?bB(g)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
| A、物质B的质量分数增大了 |
| B、物质A的转化率减小了 |
| C、平衡向逆反应方向移动了 |
| D、a>b |
下列方程式不能正确解释实验事实的是( )
| A、0.l mol?L-l CH3COOH溶液的pH>1:CH3COOH?CH3COO-+H+ |
| B、Na2CO3溶液能使酚酞试液变红:CO32-+H2O?HCO3-+OH- |
| C、铁溶于稀硝酸,溶液变黄:3Fe+8H++2NO3-?3Fe2++2NO↑+4H2O |
| D、向Mg(OH)2悬浊液中加入FeCl3溶液,出现红褐色沉淀:3Mg(OH)2(s)+2Fe3+(aq)?2Fe(OH)3(s)+3Mg2+(aq) |
下列各组物质类别,在物质分类里前者从属于后者的一组是( )
| A、纯净物、混合物 |
| B、氧化物、化合物 |
| C、单质、化合物 |
| D、化合物、混合物 |
 是一种白色晶体,其酸及盐均为强氧化剂.
是一种白色晶体,其酸及盐均为强氧化剂.