题目内容
19.下列说法或表达正确的是( )①次氯酸的电子式为
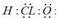
②含有离子键的化合物都是离子化合物
③强电解质溶液的导电能力一定比弱电解质溶液强
④NaHSO4在溶于水时能电离出Na+、SO42-、H+
⑤将金属a与电源的正极相连,将负极接到废铁上,可防止金属a被腐蚀.
| A. | ①③⑤ | B. | ①②③ | C. | ④⑤ | D. | ②④ |
分析 ①次氯酸为共价化合物,氯原子和氧原子都达到8电子稳定结构;
②只要含有离子键,一定属于离子化合物;
③溶液的导电能力与电解质的强弱没有必然关系;
④NaHSO4在溶于水时能电离出Na+、SO42-、H+
⑤电解池的阴极金属被保护,阳极金属易被腐蚀.
解答 解:①次氯酸的电子式中O和Cl要符合8电子结构,其电子式为: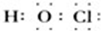 ,故①错误;
,故①错误;
②只要有离子键,一定是离子化合物,故②正确;
③溶液导电能力与离子浓度有关,与强弱电解质无关,故③错误;
④NaHSO4在水溶液中能电离出H+、Na+、和SO42-,故④正确;
⑤将金属a与电源的正极相连,将负极接到废铁上,则金属铁是阴极,被保护,金属a是阳极材料,易被腐蚀,故不能防止金属a被腐蚀,故⑤错误.
故选D.
点评 本题考查了电子式的书写、溶液导电性强弱判断、离子化合物判断、金属的腐蚀和防护等知识,题目难度中等,试题涉及的内容较多,充分考查了学生对基础知识的掌握情况.

练习册系列答案
相关题目
12.下列离子方程式书写正确的是( )
| A. | 铜片放入稀硫酸中:Cu+2H+=Cu2++H2↑ | |
| B. | 将少量NaOH溶液加入NH4HCO3溶液中:OH-+HCO3-=CO32-+H2O | |
| C. | 向NaHCO3溶液中加入少量Ca(OH)2:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| D. | Fe3O4与稀HNO3反应:Fe3O4+8H+=Fe2++2Fe3++4H2O |
7.常温下,柠檬水溶液的pH是3,其中的c(OH-)是( )
| A. | 10-11mol/L | B. | 10-3mol/L | C. | 10-7mol/L | D. | 0.1 mol/L |
14.金属镍有广泛的用途,粗镍中含有Fe、Zn、Cu、Pt等杂质,可用电解法制得高纯度的镍,下列叙述中正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )
| A. | 阴极发生还原反应,其电极反应式:Ni2++2e-═Ni | |
| B. | 电解过程中,阳极质量的减少与阴极质量的增加相等 | |
| C. | 电解后,电解槽底部的阳极泥中只有Cu和Pt | |
| D. | 电解后,溶液中存在的阳离子只有Fe2+和Zn2+ |
4.目前工业生产H2O2的一种新方法的生产过程中,会生成一种中间产物,其结构简式为: .有关该物质的说法正确的是( )
.有关该物质的说法正确的是( )
 .有关该物质的说法正确的是( )
.有关该物质的说法正确的是( )| A. | 它属于芳香烃 | B. | 它是苯的同系物的含氧衍生物 | ||
| C. | 它可发生消去反应 | D. | 它可与NaOH溶液反应 |
8.下列关于物质的量的叙述中,正确的是( )
| A. | 物质的量就是物质的数量 | |
| B. | 1 mol任何物质都含有6.02×1023个原子 | |
| C. | 1 mol水中含有1 mol氢分子和1 mol氧原子 | |
| D. | 1 mol H2分子中含有2 mol H |
8.下列说法正确的是( )
| A. | 含醛基的有机物一定能发生银镜反应 | |
| B. | 在氧气中燃烧时,只生成CO2和H2O的物质一定是烃 | |
| C. | 苯酚有弱酸性,俗称石炭酸,因此它是一种羧酸 | |
| D. | 在酯化反应中,羧酸脱去羧基中的氢,醇脱去羟基而生成水和酯 |
 已知A、B、C、D是中学化学中常见的四种10电子微粒,它们之间存在如图中转化关系.
已知A、B、C、D是中学化学中常见的四种10电子微粒,它们之间存在如图中转化关系.