题目内容
10.将100mL 1.0mol•L-1 H2SO4溶液和100mL 2.0mol•L-1 CuSO4溶液混合(假设混合后溶液的体积等于混合前两种溶液的体积之和).计算:(1)混合溶液中CuSO4的物质的量浓度;
(2)混合溶液中SO42-的物质的量浓度.
分析 (1)根据稀释定律,稀释前后溶质的物质的量不变,据此计算混合溶液中CuSO4和H2SO4的物质的量浓度;
(2)混合后溶液中c(H+)=2c(H2SO4);溶液中硫酸根来源于硫酸铜与硫酸电离,故 c(SO42-)=c(CuSO4)+c(H2SO4).
解答 解:(1)把2.0mol•L-1CuSO4和1.0mol•L-1H2SO4溶液等体积混合,根据稀释定律,稀释前后溶质的物质的量不变,则混合后溶液中c(CuSO4)=$\frac{1}{2}$×2.0mol/L=1.0 mol/L,答:混合溶液中CuSO4的物质的量浓度是1.0mol/L.
(2)混合后n(SO42-)=n(CuSO4)+n(H2SO4)=0.3mol,浓度c=$\frac{0.3mol}{0.2L}$=1.5mol/L.
答:SO42-的物质的量浓度为1.5mol/L.
点评 本题考查物质的量浓度的有关计算,比较基础,注意对公式的理解与灵活运用,注意理解稀释定律.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
2.下列关于四种粒子的结构示意图的说法中正确的是( )


| A. | ①③属于同种元素 | |
| B. | ①属于离子,离子符号为Cl-1 | |
| C. | ①④的化学性质相似 | |
| D. | ②表示的元素在化合物中通常显-1价 |
18.下列氯化物中,能直接利用金属与稀盐酸的反应得到的是( )
| A. | FeCl3 | B. | CuCl2 | C. | AgCl | D. | FeCl2 |
5.下列能够检验出碘化钾中是否含有溴离子的实验( )
| A. | 加入足量的新制氯水,溶液变色则有Br- | |
| B. | 加入酸性KMn04溶液,观察溶液颜色是否褪去 | |
| C. | 加入少量的碘水,再加入CCl4振荡,有机层有色,则有Br- | |
| D. | 加入足量FeCl3溶液,用CCl4萃取后,在无色的水层中加入氯水,溶液呈橙黄色,则含有Br- |
15.容量瓶上需要标有:①温度,②浓度,③容量,④压强,⑤刻度线,⑥碱式或酸式六项中的( )
| A. | ①③⑤ | B. | ②④⑥ | C. | ③⑤⑥ | D. | ①②③ |
19.下列说法或表达正确的是( )
①次氯酸的电子式为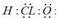
②含有离子键的化合物都是离子化合物
③强电解质溶液的导电能力一定比弱电解质溶液强
④NaHSO4在溶于水时能电离出Na+、SO42-、H+
⑤将金属a与电源的正极相连,将负极接到废铁上,可防止金属a被腐蚀.
①次氯酸的电子式为
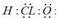
②含有离子键的化合物都是离子化合物
③强电解质溶液的导电能力一定比弱电解质溶液强
④NaHSO4在溶于水时能电离出Na+、SO42-、H+
⑤将金属a与电源的正极相连,将负极接到废铁上,可防止金属a被腐蚀.
| A. | ①③⑤ | B. | ①②③ | C. | ④⑤ | D. | ②④ |
20.由氢氧化钠(NaOH)和过氧化钠(Na2O2)组成混合物中检测出氢元素的质量分数为1%,那么混合物中钠元素的质量百分数约为( )
| A. | 46% | B. | 57.5% | C. | 58.4% | D. | 无法计算 |
 用如图所示装置进行实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.
用如图所示装置进行实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.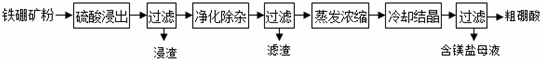
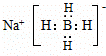 .
.