题目内容
4.目前工业生产H2O2的一种新方法的生产过程中,会生成一种中间产物,其结构简式为: .有关该物质的说法正确的是( )
.有关该物质的说法正确的是( )| A. | 它属于芳香烃 | B. | 它是苯的同系物的含氧衍生物 | ||
| C. | 它可发生消去反应 | D. | 它可与NaOH溶液反应 |
分析 由结构可知,分子中含酚-OH及苯环,结合酚性质来解答.
解答 解:A.含O元素,为烃的衍生物,故A不选;
B.含3根苯环与苯的结构不相似,不是苯的同系物的含氧衍生物,故B不选;
C.酚-OH不能发生消去反应,故C不选;
D.含酚-OH,与NaOH反应,故D选;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意酚的性质,题目难度不大.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
16.某有机物可用于合成一种常见药物达菲,其结构简式如图,下列关于该有机物的说法正确的是( )

| A. | 分子式为C7H6O5 | |
| B. | 可发生加成和取代反应 | |
| C. | 分子中含有两种官能团 | |
| D. | 在水溶液中羧基和羟基均能电离出H+ |
15.容量瓶上需要标有:①温度,②浓度,③容量,④压强,⑤刻度线,⑥碱式或酸式六项中的( )
| A. | ①③⑤ | B. | ②④⑥ | C. | ③⑤⑥ | D. | ①②③ |
12.下列说说法中,正确的是( )
| A. | 非金属性最强的元素,其最高价氧化物对应水化物的酸性最强 | |
| B. | 同一主族的元素,原子半径越大,其单质的熔点一定越高 | |
| C. | 同一主族元素的氢化物,相对分子质贤越大,它的沸点一定越高 | |
| D. | 在周期表中,主族序数都等于该族元素的最外层电子数 |
19.下列说法或表达正确的是( )
①次氯酸的电子式为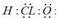
②含有离子键的化合物都是离子化合物
③强电解质溶液的导电能力一定比弱电解质溶液强
④NaHSO4在溶于水时能电离出Na+、SO42-、H+
⑤将金属a与电源的正极相连,将负极接到废铁上,可防止金属a被腐蚀.
①次氯酸的电子式为
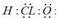
②含有离子键的化合物都是离子化合物
③强电解质溶液的导电能力一定比弱电解质溶液强
④NaHSO4在溶于水时能电离出Na+、SO42-、H+
⑤将金属a与电源的正极相连,将负极接到废铁上,可防止金属a被腐蚀.
| A. | ①③⑤ | B. | ①②③ | C. | ④⑤ | D. | ②④ |
9.下列表示物质结构的化学用语正确的是( )
| A. | 苯分子的比例模型: | B. | HF的电子式:H:F | ||
| C. | Cl-离子的结构示意图: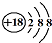 | D. | NH4Cl的电子式: |
16.有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、Cl-、I-、HCO3-,取该溶液实验如表所示:
由此判断:
(1)溶液中肯定存在的离子是NO3-、SO42- Mg2+、Al3+,
溶液中肯定不存在的离子是I-、Ba2+、Fe2+、HCO3-;
溶液中可能存在的离子是K+、Cl-.
(2)请设计实验验证原溶液中可能存在的阴离子的方法(写明操作、现象、结论)
取少许原溶液于试管中,先加入过量的硝酸钡溶液,再往上层清液中滴加硝酸银溶液,若出现白色沉淀则说明含有Cl-.
| 实验步骤 | 实验现象 |
| (1)取少量该溶液,加几滴甲基橙 | 溶液变红色 |
| (2)取少量该溶液加热浓缩,加Cu片和浓H2SO4,加热 | 有无色气体产生,气体遇空气可以变成红棕色 |
| (3)取少量该溶液,加BaCl2溶液 | 有白色沉淀生成 |
| (4)取(3)中上层清液,加AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于HNO3 |
| (5)取少量该溶液,加NaOH溶液 | 有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
(1)溶液中肯定存在的离子是NO3-、SO42- Mg2+、Al3+,
溶液中肯定不存在的离子是I-、Ba2+、Fe2+、HCO3-;
溶液中可能存在的离子是K+、Cl-.
(2)请设计实验验证原溶液中可能存在的阴离子的方法(写明操作、现象、结论)
取少许原溶液于试管中,先加入过量的硝酸钡溶液,再往上层清液中滴加硝酸银溶液,若出现白色沉淀则说明含有Cl-.
13.下列关于元素周期表的说法中不正确的是( )
| A. | 元素周期表有七个横行,也是七个周期 | |
| B. | 元素周期表有十八个纵行,也是十八个族 | |
| C. | 表中所含元素种类最少的周期是第一周期 | |
| D. | 表中所含元素种类最多的族是ⅢB族 |



