题目内容
11.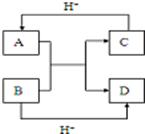 已知A、B、C、D是中学化学中常见的四种10电子微粒,它们之间存在如图中转化关系.
已知A、B、C、D是中学化学中常见的四种10电子微粒,它们之间存在如图中转化关系.请写出:A的化学式HF(或NH4+)(写一种); D的化学式H2O.
分析 10电子微粒A、B反应得到两种10电子微粒,应是NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3+H2O(或HF+OH-═F-+H2O),可推知A为NH4+,B为OH-,C为NH3,D为H2O(或A为HF,B为OH-,C为F-,D为H2O).
解答 解:10电子微粒A、B反应得到两种10电子微粒,应是NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3+H2O或HF+OH-═F-+H2O,可推知A为NH4+,B为OH-,C为NH3,D为H2O(或A为HF,B为OH-,C为F-,D为H2O),
故答案为:HF(或NH4+);H2O.
点评 本题考查无机物推断,主要考查离子反应的结构特征,熟记10电子微粒和18电子微粒及其性质,题目难度不大.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
2.下列关于四种粒子的结构示意图的说法中正确的是( )


| A. | ①③属于同种元素 | |
| B. | ①属于离子,离子符号为Cl-1 | |
| C. | ①④的化学性质相似 | |
| D. | ②表示的元素在化合物中通常显-1价 |
19.下列说法或表达正确的是( )
①次氯酸的电子式为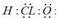
②含有离子键的化合物都是离子化合物
③强电解质溶液的导电能力一定比弱电解质溶液强
④NaHSO4在溶于水时能电离出Na+、SO42-、H+
⑤将金属a与电源的正极相连,将负极接到废铁上,可防止金属a被腐蚀.
①次氯酸的电子式为
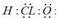
②含有离子键的化合物都是离子化合物
③强电解质溶液的导电能力一定比弱电解质溶液强
④NaHSO4在溶于水时能电离出Na+、SO42-、H+
⑤将金属a与电源的正极相连,将负极接到废铁上,可防止金属a被腐蚀.
| A. | ①③⑤ | B. | ①②③ | C. | ④⑤ | D. | ②④ |
6.将5mol/L的盐酸10mL稀释到100mL,再从中取出5mL,这5mL溶液的物质的量浓度为( )
| A. | 0.5 mol/L | B. | 0.25 mol/L | C. | 5 mol/L | D. | 1 mol/L |
16.有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、Cl-、I-、HCO3-,取该溶液实验如表所示:
由此判断:
(1)溶液中肯定存在的离子是NO3-、SO42- Mg2+、Al3+,
溶液中肯定不存在的离子是I-、Ba2+、Fe2+、HCO3-;
溶液中可能存在的离子是K+、Cl-.
(2)请设计实验验证原溶液中可能存在的阴离子的方法(写明操作、现象、结论)
取少许原溶液于试管中,先加入过量的硝酸钡溶液,再往上层清液中滴加硝酸银溶液,若出现白色沉淀则说明含有Cl-.
| 实验步骤 | 实验现象 |
| (1)取少量该溶液,加几滴甲基橙 | 溶液变红色 |
| (2)取少量该溶液加热浓缩,加Cu片和浓H2SO4,加热 | 有无色气体产生,气体遇空气可以变成红棕色 |
| (3)取少量该溶液,加BaCl2溶液 | 有白色沉淀生成 |
| (4)取(3)中上层清液,加AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于HNO3 |
| (5)取少量该溶液,加NaOH溶液 | 有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
(1)溶液中肯定存在的离子是NO3-、SO42- Mg2+、Al3+,
溶液中肯定不存在的离子是I-、Ba2+、Fe2+、HCO3-;
溶液中可能存在的离子是K+、Cl-.
(2)请设计实验验证原溶液中可能存在的阴离子的方法(写明操作、现象、结论)
取少许原溶液于试管中,先加入过量的硝酸钡溶液,再往上层清液中滴加硝酸银溶液,若出现白色沉淀则说明含有Cl-.
3.油水分离可以采用下列哪种方法( )
| A. | 过滤 | B. | 蒸发 | C. | 蒸馏 | D. | 分液 |
20.由氢氧化钠(NaOH)和过氧化钠(Na2O2)组成混合物中检测出氢元素的质量分数为1%,那么混合物中钠元素的质量百分数约为( )
| A. | 46% | B. | 57.5% | C. | 58.4% | D. | 无法计算 |
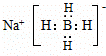 .
.